微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于0.2 mol/L 硝酸钾溶液的叙述中,正确的是 ( )
A.1 L该溶液中含硝酸钾202 g
B.100 mL 该溶液中含硝酸钾0.02 mol
C.从1 L该溶液中取出500 mL 后,剩余溶液的浓度为0.1 mol/L
D.1 L水中溶解0.2 mol 硝酸钾,即可配得0.2 mol/L 硝酸钾溶液
参考答案:B
本题解析:A错,1 L该溶液中含硝酸钾20.2 g;B正确;C错,溶液的浓度与溶液的体积无关;D错,不知道溶液的体积无法计算;
本题难度:一般
2、选择题 下列说法中正确的是( )
A.纯净的空气和含镁60%的MgO都是纯净物
B.纯碱和熟石灰都是碱
C.二氧化硅是酸性氧化物,所以它不溶于任何酸
D.从1L0.1mol/L的NaCl溶液中取出0.1L溶液,则NaCl的物质的量为0.01mol
参考答案:A、空气中主要含有N2和O2,还含有CO2,则空气一定是混合
本题解析:
本题难度:一般
3、填空题 (每空2分,共14分)(1)483g Na2SO4·10H2O中所含的Na+的物质的量是 和SO42—的物质的量是 ,所含H2O分子的数目是 个。
(2)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是________;
(3)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
参考答案:21.(1)3mol 1.5mol&#
本题解析:
试题分析:(1)根据n= =
= 结合物质的组成计算相关物理量并且摩尔质量在数值上等于相对分子质量,M(Na2SO4?10H2O)=322g/mol,n(Na2SO4?10H2O)=
结合物质的组成计算相关物理量并且摩尔质量在数值上等于相对分子质量,M(Na2SO4?10H2O)=322g/mol,n(Na2SO4?10H2O)=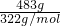 =1.5mol,n(Na+)=2n(Na2SO4?10H2O)=2×1.5mol=3mol,n(SO42-)=n(Na2SO4?10H2O)=1.5mol,n(H2O)=10n(Na2SO4?10H2O)=10×1.5mol=15mol,N(H2O)=15mol×NA个/mol=15NA(或9.03×1024),答案为:1.5mol;322g/mol;1.5mol;3mol;15NA(或9.03×1024)。(2)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故同温同压下,同体积的氨气(NH3)和氧气的质量比为17g/mol:32g/mol=17:32,同温同压下,同质量的气体的体积之比与摩尔质量成反比,故同温同压下,相同质量的氨气和氧气的体积比为32g/mol:17g/mol=32:17,答案为:17:32,32:17;(3)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故0.2g:1.6g=2g/mol:M(A),解得M(A)=16g/mol,故A的相对分子质量为16,1.6gA的物质的量为
=1.5mol,n(Na+)=2n(Na2SO4?10H2O)=2×1.5mol=3mol,n(SO42-)=n(Na2SO4?10H2O)=1.5mol,n(H2O)=10n(Na2SO4?10H2O)=10×1.5mol=15mol,N(H2O)=15mol×NA个/mol=15NA(或9.03×1024),答案为:1.5mol;322g/mol;1.5mol;3mol;15NA(或9.03×1024)。(2)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故同温同压下,同体积的氨气(NH3)和氧气的质量比为17g/mol:32g/mol=17:32,同温同压下,同质量的气体的体积之比与摩尔质量成反比,故同温同压下,相同质量的氨气和氧气的体积比为32g/mol:17g/mol=32:17,答案为:17:32,32:17;(3)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故0.2g:1.6g=2g/mol:M(A),解得M(A)=16g/mol,故A的相对分子质量为16,1.6gA的物质的量为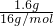 =0.1mol,A的分子数目为0.1mol×NAmol-1=0.1NA,答案为:16,0.1NA或6.02×1022。
=0.1mol,A的分子数目为0.1mol×NAmol-1=0.1NA,答案为:16,0.1NA或6.02×1022。
考点:考查物质的量的相关计算。
本题难度:一般
4、选择题 由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比不可能为
A.39:24:13
B.22:7:14
C.13:8:29
D.26:16: 57
参考答案:B
本题解析:
试题分析:同温同压下密度之比等于摩尔质量之比,CO的摩尔质量与N2的相同,所以只要求出CO2和H2的平均摩尔质量是28g/mol即可。方法一:(44nCO2+2n H2) / (nCO2+n H2)="28" 所以nCO2 / nH2=13:8,因此应选B。
本题难度:一般
5、选择题 下列说法正确的是(NA为阿伏加德罗常数的值)
A.1L0.1mol·L的Na2S溶液中,含S2-的数目为0.1NA
B.在密闭容器中加入1molN2和3molH2,充分反应后可得到NH3的分子数为2NA
C.1mol-CH3(甲基)中含有9NA个电子
D.常温常压下,22.4L氯气与足量镁粉完全反应,转移电子的数目为2NA
参考答案:C
本题解析:
试题分析:A、S2-发生水解水解反应使硫离子数目减少,错误;B、氮气与氢气的反应是可能反应,所以不可能生成氨气的分子数是2NA,错误;C、1个甲基中的电子数是9,所以1mol-CH3(甲基)中含有9NA个电子,正确;D、常温常压下,22.4L氯气的物质的量不是1mol,所以与镁反应转移的电子数不是2NA,错误,答案选C。
考点:考查阿伏伽德罗常数与微粒数的关系
本题难度:一般