微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某校研究性学习小组设计了如下实验步骤来提取碘:
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为???????
A.②→④→①→③→⑤
B.②→①→③→④→⑤
C.③→①→②→⑤→④
D.①→③→⑤→②→④
参考答案:A
本题解析:要提取碘,则应该用氧化剂把碘离子氧化生成单质碘,然后利用碘单质易溶在有机溶剂中,通过萃取即可,答案选A。
本题难度:简单
2、选择题 用氯气消毒过的自来水配制下列溶液时,会使所配的溶液的溶质发生变化的是(???)
①NaOH?②AgNO3?③Na2CO3?④NaBr?⑤KI
A.只有①②
B.只有①④⑤
C.只有②④⑤
D.①②③④⑤
参考答案:D
本题解析:氯气所配的自来水含有氯分子、次氯酸、氢离子、氯离子等离子,它们可与氢氧化钠、硝酸银、碳酸钠、溴化钠、碘化钾都发生反应。
本题难度:简单
3、实验题 利用铝热反应焊接钢轨的原理是2Al+Fe2O3 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入???????????????????溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有?????????????????????????????;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
实验操作
| 预期现象和结论
|
 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。
| ?
|
步骤2:将步骤1的滤渣转移到烧杯B中,加入足量?????????????,充分搅拌,过滤,洗涤。
| 有红色固体生成,说明粉末中含有
???????????????????????????。
|
步骤3:将步骤2的滤渣转移到烧杯C中,
???????????????????????????????
???????????????????????????????。
| ?
???????????????????????????????
??????????????????????????????,
说明粉末中含有Fe2O3。(1分)
?
参考答案:(1) NaOH (1分)?????????????????
本题解析:考查铝、铁及其化合物的性质及检验,铝热反应涉及物质无所谓是铁铝两金属单质及其对应的氧化物
(1)通过实验结论可知,通过该步骤来检验铝及其氧化物的存在:一般是通过用NaOH碱液来检验,涉及反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O,可通过是否有气体生成来判定是否有铝,固体是否溶解来判定是否有Al2O3
(2)Fe、Fe2O3、Al2O3三种物质中,已经确定Al2O3的存在,那么固体的组成无所谓就是三种情况:①Fe2O3、Al2O3②Fe、Al2O3③Fe、Fe2O3、Al2O3
(3)实验的主要目的是确定Fe、Fe2O3是否存在,依据所给部分信息可知
步骤1当然是溶解除去Al2O3
步骤2:结论有红色固体生成,说明是生成了铜,可知原样品中一定含有铁,将可溶性铜盐(最常用的就是硫酸铜溶液)置换所致
步骤3:很明显本步骤是要检验Fe2O3的存在,对于三价铁的检验,一般用KSCN溶液,故可用酸液将滤渣溶解后用KSCN来观察是否有血红色现象产生即可
点评:本题本质是对铁、铝及其化合物的检验,起点高,但落点较低,都是日常学生常见的习题;但综合性较高
本题难度:一般
4、填空题 室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
 假设三:????????????????????????????????????????; 假设三:????????????????????????????????????????;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10??? KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设??????????????是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,②??????,③干燥。???????????
步骤三:利用下图所示装置,进行定量分析:
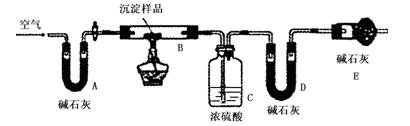
① A装置中玻璃仪器的名称是??????????????。
② 仪器组装好后首先要进行的实验操作是?????????????????。
③ 实验结束时通入过量的空气的作用是 ?????????????????。
④ 数据记录:
?
| B装置的质量(g)
| C装置的质量(g)
| D装置的质量(g)
| 实验前
| 15.4
| 262.1
| 223.8
| 试验后
| 6.1
| 264.8
| 230.4
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为????????????????????。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式?????????????????????????????????。
参考答案:(一)uCO3和Cu(OH)2的混合物[2分。如果答Cu2(
本题解析:略
本题难度:一般
5、实验题 (16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是???????
A.FeCl3
B.FeCl2
C.CuCl2
D.FeS

(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用:??????????????????????????????。开始加热前????????(填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是????????????????????????????????????????????????????????;该反应的离子方程式为??????????????????????????????。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由:????????????????????????????????(若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象??????????????????????????????????????????????????????????。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为???
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):①??????????????????????????②???????????????????
参考答案:
 本题解析:考查铁铜与硝酸的反应 本题解析:考查铁铜与硝酸的反应
(1)由于氯气的氧化性强,与铁铜反应生成的均为高价氯化物,而硫的氧化性相对较弱,与铁铜只能生成低价硫化物,故答案为B
(2)由于硝酸的强氧化性,铁在冷的浓硝酸中钝化,故不加热时无反应,也无现象
加热时可能发生反应:Fe+6HNO3(浓)=Fe(NO3)3+3NO2↑+3H2O
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
2Fe3++Fe=3Fe2+
由于NO与NO2可被碱液吸收,故为防止倒吸,采用B装置,起到安全瓶的作用
(3)①剩余的硝酸或生成的Fe(NO3)3均可溶解铜
3Cu+2NO3-+8 H+="3Cu" 2++2NO↑+4 H2O (2分);
2Fe(NO3)3+Cu=Cu(NO3)2+2Fe(NO3)2(2分)。
故可通过观察是否有气泡产生来判定是那种物质来氧化铜
②考查铁离子的检验:一般采用加入KSCN溶液是否呈现血红色来检验
③所得溶液为硝酸铜及硝酸亚铁的混合溶液,它们的物质的量均为0.01mol,故NO3—的物质的量为0.04mol,其物质的量浓度为0.08mol/L;
设NO、NO2的物质的量分别x、y,则x+y=0.02
由电子的得失守恒可知:3x+y=(0.01+0.01)×2(金属铁、铜的物质的量也均为0.01mol)
求得x=y=0.01mol,即两气体的体积在标准状况下均为0.224L
(4)由氮原子的守恒可知硝酸的物质的量理论上为0.04+0.02=0.06mol,而实际消耗硝酸为: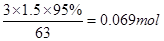 ,可能由于硝酸为热不稳定酸,易挥发,均可造成它的损耗 ,可能由于硝酸为热不稳定酸,易挥发,均可造成它的损耗
本题难度:简单
|
|