微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)某研究性学习小组的同学探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)写出反应②的离子反应方程式__________________________________________。
(2)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是_____________________________________。
(3)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3?6H2O晶体,是将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3?6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是__________________
(4)丙同学设计如下方案测定甲同学所制得的绿矾晶体中结晶水含量,其方法过程如下
①称取mg己研细的新制得的绿矾晶体,称量的方法是___________
a.直接将晶体放置于天平托盘上所垫的纸片上称量
b.将晶体置于干燥的坩埚中,然后再按a中操作进行称量
c.将晶体置于己准确称量的干燥坩埚中,然后再按a中操作进行称量
②在氮气流环境中加热坩埚中晶体使其失去全部结晶水后再停止加热,并仍在氮气流环境下冷却。放在氮气流中加热与冷却的原因是____________________________
③将坩埚放在天平上进行称量,称得质量为n1g
④重复②、③的操作,称得的质量为n2g,表明不需要再加热再称量的依据是________
⑤下表数据来是该同学实验报告中的数据,试求出晶体中X=_______
实验编号
| 坩埚质量
| 坩埚与晶体总质量
| 加热后坩埚与固体总质量
|
1
| 11.2g
| 25.1g
| 19.2g
|
2
| 11.2g
| 25.1g
| 18.8g
|
3
| 11.2g
| 25.1g
| 18.9g
参考答案:(1)AlO2- + CO2 + 2H2O= Al(OH)3
本题解析:三种金属中只有铝能与碱反应生成NaAlO2、通过足量CO2后生成Al(OH)3溶液与NaHCO3。易知E是铜,铜与稀硫酸不反应,故Y有较强的氧化性,结合其为液体知为H2O2;D是FeSO4,可用NaOH 来检验Fe2+。FeCl3是挥发性酸的弱碱盐,直接加热盐溶液时能促使水解进行到底。
应先称量坩埚质量,再称坩埚与药品质量和;亚铁盐在温度较高的条件很易被空气氧化,故应放在氮气流中进行实验;当再次称量数据与第n1相差不超过0.1g时表明符合要求。因2、3两次称量结果相近而第一次与另外两次相差较大,故用2、3两次称量结果的平均值进行计算。
本题难度:一般
2、选择题 小张用白纸和无色溶液给表弟写了一封“无字”信,表弟接到信拆开一看觉得很愕然,但沉思一下便明白小张的意 思。经过用另一溶液简单处理后,表弟看到了一封有颜色的信,并很快写了回信。小张和表弟所用的溶液分别可能是(?????)。?????????????????????????? 思。经过用另一溶液简单处理后,表弟看到了一封有颜色的信,并很快写了回信。小张和表弟所用的溶液分别可能是(?????)。??????????????????????????
A.前者是紫色石蕊试液,后者是稀盐酸
 | B.前者是NaOH稀溶液,后者是稀硫酸
C.前者是浓硫酸,后者是紫色石蕊试液
D.前者是米汤,后者是碘酒
参考答案:D
本题解析:略
本题难度:简单
3、实验题 化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分。利用已学知识对下列实验进行分析并填空:
Ⅰ.??????????????????????????????????????????????????????
实验
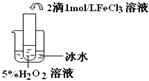 ? ?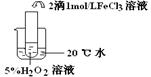 ?? ??
实验结论?结论:?????????????????????????????????????????????????????????
FeCl3在实验中的作用为:??????????????
反应方程式???????????????????????????????
II.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:
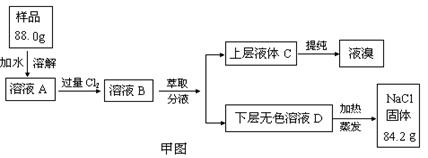
阅读上述资料和实验过程,完成下列填空:
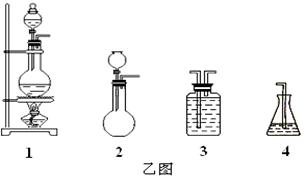
(1)请从下方乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品。
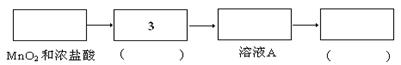
(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为?????????(填选项字母)
A. 碘水????????????????????????????????? B. 淀粉碘化钾溶液?????
C. 新制氯水和四氯化碳???????????????? D. 食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为??????
A. 四氯化碳???????B. 水????? C. 乙醇????????? D. 苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
???????????????????????????????????????????????????
(5)试计算原固体混合物中氯化钠的质量分数为????????%
参考答案:Ⅰ.实验目的:探究温度对H2O2分解反应速率的影响
温
本题解析:Ⅰ.根据实验装置图及试剂可知,目的是检验探究温度对H2O2分解反应速率的影响。根据实验现象可知,温度越高,反应速率越快。在该反应中氯化铁起催化剂的作用,方程式为2H2O2 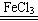 ?2H2O + O2 ↑。 ?2H2O + O2 ↑。
Ⅱ. (1)生成的氯气中含有氯化氢气体,所以需要利用饱和食盐水除去氯化氢。氯气有毒,所以尾气处理,用氢氧化钠吸收氯气。
(2)如果含有溴离子,在可利用氯水的氧化性把溴离子氧化生成单质溴,然后利用四氯化碳除去即可,答案选C。
(3)水和乙醇不能用作萃取剂,根据图可知,上层是有机层,说明萃取剂的密度小于水的,所以答案选D。
(4)这样做的目的是内外气压相通,使分液漏斗内液体能够顺利流下。
(5)反应的方程式为?????? Cl2????+?? 2NaBr=Br2???+?? 2NaCl
206g???????????? 117g
m????????????(88g-84.2g)=3.8g
所以m=6.7g
则氯化钠的质量是88g-6.7g=81.3g
所以质量分数为81.3÷88×100%=92.4%
本题难度:一般
4、填空题 (12分)

?
白云石(主要成分为CaCO4,MgCO2)可用作碱性耐火材料和高炉炼铁的溶制等。??(1)甲同学利用加热法测定白云石中MgCO2的含量,
实验曲线如右图(MgCO4的分解温度比CaCO2
低)
①700℃(即B点)对剩余固体的主要成分为
????????(填化学式)。
②该白云石中MgCO3的质量分数为?????????
(保留3位有效数字)。
(2)乙同学利用滴定法测定白云石中MgCO3的含量。已知:①滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应,可用K—B指示剂作为该滴定反应的指示剂;②实验条件下。Mg2+开始沉淀时的pH为10,沉淀完全时的pH为11.2,Ca2+开始沉淀时的pH为12。
步骤1:准确称取白云石试样m g,在烧杯中用适量稀盐酸完全溶解;
步骤2:冷却后全部转移到250mL容量瓶中定容,
步骤3:从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;
步骤4:加入2滴K—B指示剂,以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V1mL;
步骤5:再从容量瓶中移取试液25.00mL,?????????;
步骤6:加入2滴K—B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL。
①根据上述分析数据,测得该白云石试样中MgCO3的质量分数为????(用含字母的代数式表示)。
②配制100mL c mol/L EDTA标准溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒,
????????????。
参考答案:(12分)
(1)①MgO和CaCO3(2分)???②
本题解析:略
本题难度:一般
5、选择题 用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 (?? )
 A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|