微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列不能证明一元酸HA为弱酸的是(???)
A.NaA溶液的pH>7(室温下)
B.pH试纸显示0.1 mol/L HA溶液的pH为2~3(室温下)
C.0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强
D.HA溶液能与CH3COONa溶液反应生成CH3COOH
参考答案:D
本题解析:
试题分析:室温下,强碱弱酸盐由于水解,其溶液的pH>7,故A能够证明一元酸HA为弱酸,故A不能选;若一元酸HA为强酸,则0.1 mol/L HA溶液的pH在室温下应该为1,而用pH试纸显示0.1 mol/L HA溶液的pH为2~3,说明HA为弱酸,故B不能选;0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强,这可以说明一元酸HA为弱酸,故C正确;HA溶液能与CH3COONa溶液反应生成CH3COOH,只能说明HA的酸性比醋酸强,但是否为弱酸还不能确定,故D为本题的正确答案。
点评
本题难度:简单
2、填空题 对于弱酸在-定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.若在25℃时有HA?H++A-,则K=c(H+)?c(A-)/c(HA),式中K为电离平衡常数,只与温度有关,各粒子的浓度为达到平衡时的浓度.下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | 点解方程式 | 电离平衡常数
CH3COOH
CH3COOH?CH3COO-+H+
K=1.76×10-5
H2CO3
H2CO3?HCO3-+H+
HCO3-?CO32-+H+
K1=4.31×10-7
K2=5.61×10-11
H2S
H2S?HS-+H+
HS-?S2-+H+
K1=9.1×10-8
K2=1.1×10-15
H3PO4
H3PO4?H2PO4-+H+
H2PO4-?HPO42-+H+
HPO42-?PO43-+H+
K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13
回答下列问题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)
(2)在温度相同时,各弱酸K值不同,那么K值的大小与酸性相对强弱的关系是:______.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是______,最弱的是______.
(4)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时cmol/L的CH3COOH的电离度为α(当若电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子占原来总分子数的百分数叫做该电解质的电离度).试表示该温度下醋酸的电离平衡常数K=______.
参考答案:(1)弱电解质的电离是吸热反应,升高温度促进弱电解质电离,则
本题解析:
本题难度:简单
3、选择题 某弱酸溶液中存在电离平衡HA?H++A-,下列叙述不正确的是( )
A.溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B.0.10?mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C.HA溶液中加少量的NaA固体,平衡逆向移动
D.常温下,加入NaA固体可使HA的电离常数增大
参考答案:A.溶液呈电中性,阴阳离子所带电荷相等,根据电荷守恒得:c(
本题解析:
本题难度:简单
4、选择题 下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式
| AgCl
| Ag2CrO4
| CH3COOH
| HClO
| H2CO3
| Ks或Ka
| Ksp=1.8×10-10
| Ksp=2.0×10-12
| Ka=1.8×10-5
| Ka=3.0×10-8
| Ka1=4.1×10-7
Ka2=5.6×10-11
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
C.碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 + Cl2+H2O =HCO-3+Cl-+HClO
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO2-4先形成沉淀
参考答案:C
本题解析:
试题分析:A、根据表中醋酸和次氯酸的电离常数知酸性:CH3COOH>HF,根据盐类水解规律:组成盐的酸根对应的酸越弱该盐的水解程度越大知,相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),错误;B、向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时醋酸根的水解程度大于醋酸的电离程度,溶液pH>7,错误;C、酸性:HCl>H2CO3>HClO>HCO3—,碳酸钠溶液中滴加少量氯水的离子方程式为CO32—+ Cl2+H2O =HCO-3+Cl-+HClO,正确;D、根据AgCl和Ag2CrO4的Ksp判断向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加AgNO3溶液,Cl-沉淀所需的Ag+浓度应大于1.8×10—5 mol·L-1,CrO42—沉淀所需的Ag+浓度应大于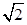 ×10—4.5 mol·L-1,Cl-先形成沉淀,错误。 ×10—4.5 mol·L-1,Cl-先形成沉淀,错误。
考点:考查溶液中的离子平衡。
本题难度:困难
5、填空题 完全中和9.8g三元含氧酸酸H3AO4,消耗氢氧化钠12g,此三元酸物质的量是__ ______,相对分子质量是_____ __.已知该酸是弱酸,请用其实际化学式分三步写出电离方程式 。
参考答案:0.1mol 98 H3
本题解析:略
本题难度:一般
|
|