微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
A.四种溶液的KW相同,由水电离的c(H+):①=③>②=④
B.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>①
C.①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>②
参考答案:B
本题解析:
试题分析:A、因为①和②溶液中的水电离出的氢氧根离子浓度为10-12mol/L,③和④溶液中水的电离的氢离子浓度为10-12mol/L,,所以四种溶液中水的电离程度相同,不选A;B、③和④是碱,由于弱碱有电离平衡的移动,所以稀释相同倍数后,pH稍大些,①和②是酸,由于醋酸是弱酸,有电离平衡移动,所以稀释相同倍数后pH稍小些,所以溶液的pH的顺序为:③>④>②>①,正确,选B;C、三种溶液加入铝都可以反应生成氢气,但由于醋酸是弱酸,不完全电离,所以醋酸的浓度最大,产生的氢气最多,不选C;D、②和③混合符合pH加和等于14的酸碱等体积混合,谁弱显谁性,所以等体积混合后溶液显碱性,要得到中性溶液,则酸的体积要大些,不选D。
考点:强弱电解质的比较,溶液的pH的计算
本题难度:一般
2、填空题 (11分)
(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1) 烧杯中放入锌的质量大(填“甲”或“乙”);
(2) 烧杯中的酸过量(填“甲”或“乙”);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+) (填“大”或“小”)。
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸 ④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B ⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是 。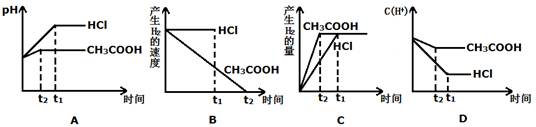
参考答案:(11分)
(Ⅰ)(1)甲 &#
本题解析:
试题解析:(I)(1)盐酸为强酸,醋酸为弱酸。体积和pH相等,可得n(HCl)<n(CH3COOH)。由于金属跟盐酸、醋酸的反应都是按1:2的比例进行反应的。因此与盐酸反应的锌应过量。
(2)得到相同质量的氢气,则反应掉的酸的物质的量相等,因此乙中的醋酸应剩余。
(3)反应后甲烧杯中的溶质为ZnCl2,乙烧杯中的溶质为(CH3COO)2Zn和CH3COOH;乙烧杯中的溶液为酸性,因此应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大。
(Ⅱ)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应。⑴若锌完全反应,则产生的H2相等;若醋酸完全反应,则产生的H2不相等。因此①②错误。⑵由于加入的锌的质量相等,而溶液中n(HCl)<n(CH3COOH),因此若有一份溶液中的锌有剩余,则应是盐酸中的锌有剩余,故③正确。⑶等倍稀释后,由于稀释促进了醋酸的水解,醋酸中c(H+)增大,因此反应速率增大,故④错误。⑷由于随着反应的进行,盐酸中c(H+)不断减小,而对于醋酸溶液中,c(H+)几乎保持不变,因此产生等量的H2所需的时间A>B,故⑤正确。⑸若产生等量的H2,可以是两种酸都有剩余,也可以是醋酸有剩余,故⑥错误。综上,说法正确的有③⑤。
(Ⅲ) 向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,反应后溶液的溶质分别为“ZnCl2和ZnCl2、CH3COOH”,因此A正确。对于选项B、对于产生H2的速率,应是与盐酸反应的会越来越慢;与醋酸反应的,其反应速率基本保持不变,故B错误。选项C、锌的质量相等,其完全反应,因此产生H2的质量想的,再结合对选项B的分析,可知,C图像表示的正确。选项D、随着反应的进行,盐酸中c(H+)不断减小,但醋酸会不断电离出H+,因此其浓度减小的较慢,因此选项D说法正确。综上,答案选ACD。
考点:电解质溶液;弱酸的电离
点评:本题考查电解质溶液的相关知识,是高考的常见考题,掌握弱酸的电离是解题的关键。对于此类题型,应加强训练总结,以求达到举一反三的效果。
本题难度:一般
3、选择题 相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
[???? ]
A.弱酸溶液产生较多的氢气
B.强酸溶液产生较多的氢气
C.两者产生等量的氢气
D.无法比较两者产生氢气的量
参考答案:A
本题解析:
本题难度:一般
4、选择题 体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述错误的是[???? ]
A.它们分别与足量CaCO3反应时,放出的CO2一样多
B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
C.两种溶液的pH相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
参考答案:A
本题解析:
本题难度:一般
5、选择题 体积相同,pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量
A.相同
B.HCl多
C.CH3COOH多
D.无法比较
参考答案:C
本题解析:
试题分析:HCl溶液是强电解质溶液,CH3COOH溶液是弱电解质溶液,pH相同时,CH3COOH溶液的浓度更大,故中和是消耗NaOH的物质的量更多。
考点:强弱点接孩子的酸碱中和反应。
本题难度:一般