微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题: CH3OH、H2的燃烧热分别为:△H=-725.5kJ·mol-1.△H= -285. 8kJ·mol-1,写出工业上以CO2.H2合成CH3OH的热化学方程式:____。
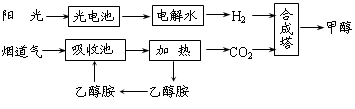
参考答案:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)
本题解析:
本题难度:一般
2、填空题 已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(1)用太阳能分解5mol液态水消耗的能量是______kJ;
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为______;
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为______;?理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______.(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
参考答案:(1)H2的燃烧热△H分别为-285.8kJ?mol-1,分
本题解析:
本题难度:一般
3、选择题 为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
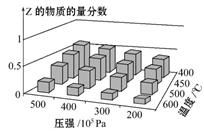
A.ΔH<0 a+b>c
B.ΔH<0 a+b<c
C.ΔH>0 a+b>c
D.ΔH>0 a+b<c
参考答案:A
本题解析:
试题分析:由图像可知对于反应aX(g)+bY(g) cZ(g),随压强增大,Z的物质的量分数减小,故平衡正向移动,故a+b>c,随温度降低Z的物质的量分数减小,故正向为放热方向,故ΔH<0,故A项正确;本题选A。
cZ(g),随压强增大,Z的物质的量分数减小,故平衡正向移动,故a+b>c,随温度降低Z的物质的量分数减小,故正向为放热方向,故ΔH<0,故A项正确;本题选A。
考点:外界条件化学平衡的影响。
本题难度:一般
4、简答题 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)??

??CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?

??CH3OH(g)+H2O(g)△H2
①在以上制备甲醇的两个反应中:反应I优于反应II,原因为______.
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃
K
2.041
0.270
0.012
I、在一密闭容器中发生反应Ⅰ并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应______移动(填“正向”、“逆向”、“不”).
II、某温度下,将1mol?CO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为______,此时的温度______250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO?(g)+O2(g)=2CO2(g)△H2=-Q2?kJ/mol③H2O(g)=H2O(l)△H3=-Q3?kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:______
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将______填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:______.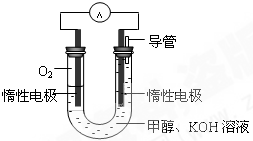
参考答案:(1)反应I中反应物完全转化,子利用率为100%,符合“原子
本题解析:
本题难度:一般
5、填空题 (16分)请你利用所学反应原理知识解决下列问题:
(1)若已知两个反应:①C(s)+2H2(g)=CH4(g) ΔH1=" a" kJ·mol-1 ;
②C(s)+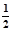 O2(g)=CO(g) ΔH2=" b" kJ·mol-1 ; O2(g)=CO(g) ΔH2=" b" kJ·mol-1 ;
则2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH= (用含a、b的式子表示);
(2)碱性镁锰干电池是新开发的一种干电池,比普通锌锰干电池具有更加优越的性能,具有较大应用前景,其工作时总反应为:Mg+2MnO2+H2O=Mg(OH)2+Mn2O3;则工作时,正极发生 反应(填反应类型),写出负极的电极反应式: ;
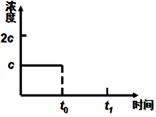
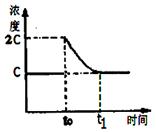
(3)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s) CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像; CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像;
(4)某温度下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的K=1.75×10-5;碳酸的 K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4) =5.0×10-9;Ksp(CaCO3) =2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是 ;
②向0.6 mol/L的Na2CO3溶液中加入足量 CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq) + CaC2O4(s)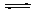 CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。 CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。
参考答案:(1)ΔH=2(b-a) kJ·mol¯
本题解析:
试题分析:(1)将②×2-①×2可得2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=2(b-a) kJ·mol¯1。(2)正极得到电子,发生还原反应;Mg做负极,反应后生成Mg(OH)2,负极的电极反应为:Mg+2OH——2e—=Mg(OH)2。(3)5 min 内生成CaO的质量为11.2 g 的物质的量为0.2mol,根据反应生成0.2mol的CaO同时生成0.2mol的CO,则v(CO)=" 0.2mol÷1L÷5" min=0.04mol·L-1·min-1。t0 时刻,将容器体积缩小为原来的一半并固定不变,则CO2的浓度变为2c,在t1时刻再达到平衡,CO2的浓度随时间变化的图像为:
(4)①从电离常数可以知道,HC2O4—>CH3COOH>H2CO3,醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是:一种固体溶解同时产生气泡逸出,另一种固体无现象
②解:该反应的K=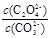 = =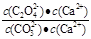 = = = =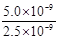 =2.0, 设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x), 可得方程: x/(0.6-x) =2.0,解得x=0.4 mol·L¯1。 =2.0, 设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x), 可得方程: x/(0.6-x) =2.0,解得x=0.4 mol·L¯1。
考点:盖斯定律的应用、化学反应速率的计算、化学图像的绘制、电离平衡常数和酸的强弱关系、电离平衡常数的有关计算。
本题难度:困难
|