微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、
2800 kJ/mol,则下列热化学方程式正确的是[???? ]
A.C(s)+1/2O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
参考答案:D
本题解析:
本题难度:简单
2、简答题 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)??

??CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?

??CH3OH(g)+H2O(g)△H2
①在以上制备甲醇的两个反应中:反应I优于反应II,原因为______.
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃
K
2.041
0.270
0.012
I、在一密闭容器中发生反应Ⅰ并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应______移动(填“正向”、“逆向”、“不”).
II、某温度下,将1mol?CO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为______,此时的温度______250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO?(g)+O2(g)=2CO2(g)△H2=-Q2?kJ/mol③H2O(g)=H2O(l)△H3=-Q3?kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:______
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将______填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:______.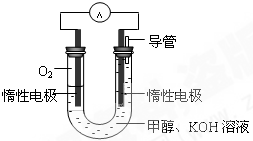
参考答案:(1)反应I中反应物完全转化,子利用率为100%,符合“原子
本题解析:
本题难度:一般
3、选择题 下列有关热化学方程式的叙述中,正确的是( ) A.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l)△H=+57.4kJ/mol
B.已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定
C.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2则△H1<△H2
参考答案:D
本题解析:
本题难度:一般
4、填空题 X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
| X
| X的某种氢化物能使湿润的红色石蕊试纸变蓝
| Y
| 单质是良好的半导体材料,广泛应用于光电信息领域
| Z
| Z的一种核素质量数为27,中子数为14
| W
| 最高价氧化物对应的水化物是一种不溶于水的蓝色固体
(1)Z位于元素周期表第 周期第 族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的 (填“大”或“小”),X的单质分子中σ键和π键的数目比为 ,Y氧化物属于 晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式 。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s) △H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s) △H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是 。
参考答案:
(1)三 ⅢA 1s22s22
本题解析:
试题分析:根据题意可以推知X、Y、Z、W分别为N、Si、Al、Cu。
(1)Cu为29号元素,故其电子排布式为[Ar]3d94s2;
(2)同周期从上到下,第一电离能依次减小,有N>P;P为3p3,半充满结构,P>Si;因此N>P>Si;氮氮三键中有1个σ键和2个π键;SiO2为原子晶体。
(3)由反应物和产物可以写出
(4)目标反应等于反应②×2-①,根据盖斯定律可得。
考点:本题以物质结构为基础,考查了原子结构、分子结构、晶体结构、元素周期律、盖斯定律及热化学方程式的书写等相关知识。
本题难度:困难
5、填空题 研究硫及其化合物的性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)
参考答案:
本题解析:
本题难度:困难
|
|
网站客服QQ: 960335752 - 14613519 - 791315772