微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在氯化铵溶液中,下列关系正确的是(??)。
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
B.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
C.C(Cl-)=C(NH4+)>C(H+)=C(OH-)
D.C(NH4+)=C(Cl-)>C(H+)>C(OH-)
参考答案:A
本题解析:氯化铵水解显酸性,所以A正确,其余选项都是错误的。答案选A。
本题难度:简单
2、填空题 (14分)常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
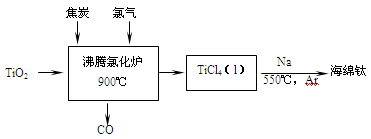
(1)TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为 。

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K= 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是 (填序号)。
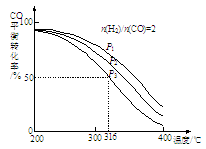
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
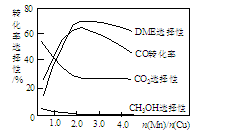
催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
参考答案:(14分)
(1)TiCl4 + 4H2O=Ti(OH
本题解析:
试题分析:(1) TiCl4遇水强烈水解,生成氯化氢和氢氧化钛,化学方程式是TiCl4 + 4H2O=Ti(OH)4↓+ 4HCl↑;或TiCl4 + 3H2O=H2TiO3↓+ 4HCl↑;
(2)①氯气与钢瓶中的铁反应生成的氯化铁对氯气与苯的反应有催化作用,所以钢瓶表面氯与苯的反应明显加快;
②根据图可知,银离子向通入氯气的一极移动,说明通入氯气的一极是阴极,所以氯气得到电子生成氯离子与银离子反应生成氯化银沉淀,电极反应式是Cl2 + 2e- + 2Ag+ ="=" 2AgCl;
③根据KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O,当生成6.72LCl2(标准状况下)物质的量是0.3mol时,消耗氯酸钾的物质的量是0.1mol,氯酸钾中Cl元素的化合价从+5价降低到0价,得到5个电子,则0.1mol氯酸钾参加反应得到电子的物质的量是0.5mol,所以该过程中转移的电子的物质的量为0.5mol;
(3)①根据平衡常数的定义,可知该反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(H2)4c(CO)2];
②a、压强一定时,温度升高,CO的转化率降低,说明升高温度,平衡逆向移动,则该反应是放热反应,△H <0,正确;b、压强增大,平衡正向移动,则CO的转化率增大,所以P1>P2>P3,错误;c、若在P3和316℃时,起始时n(H2)/n(CO)=3,即增大氢气的浓度而CO的浓度不变,则平衡正向移动,所以达到平衡时CO的转化率增大,大于50%,错误,答案选a;
③根据图可知,当CO的转化率最大、DME的选择性最大值时对应的横坐标大约在2.0附近,所以n(Mn)/n(Cu)约为2.0时最有利于二甲醚的合成。
考点:考查对物质性质的分析,化学平衡移动的判断,对图像的分析判断
本题难度:困难
3、选择题 下列关于电解质溶液的叙述不正确的是
A.常温下,pH=7的CH3COONa与CH3COOH的混合溶液中离子浓度大小顺序为c(Na+)=c(CH3COO-)>c(H+)= c(OH-)
B.将pH=10的氨水稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量前者小于后者
D.常温下,同浓度的Na2CO3溶液与NaHCO3溶液相比,Na2CO3溶液的pH较大
参考答案:B
本题解析:
试题分析:
A、常温下,pH=7的溶液为中性,即c(H+)= c(OH-),根据电荷守恒,可得c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),所以得c(Na+)=c(CH3COO-)>c(H+)= c(OH-),故A正确;
B、将pH=10的氨水稀释后,溶液中主要离子的浓度,如铵根离子、氢离子浓度均降低,但是温度不变时,水的离子积KW=c(H+) c(OH-)为常数,当c(OH-)减小时,可推知c(H+)增大,故B不正确;
C、pH与体积均相同的盐酸和醋酸溶液,后者溶质的物质的量更大,所以消耗NaOH的物质的量前者小于后者,故C正确;
D、常温下,同浓度的Na2CO3溶液与NaHCO3溶液相比,前者的水解程度大,故前者的pH较大,故D正确。
考点:考查弱电解质的稀释、盐类的水解、酸碱中和、电荷守恒的应用
点评:本题考查了弱电解质的稀释、盐类的水解、酸碱中和、电荷守恒的应用,难度不大。要注意电荷守恒
的应用,以及酸的强弱与中和碱能力的关系。
本题难度:一般
4、填空题 (6分)下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K 2CO3 , 溶液呈 性;
Na2SO4 , 溶液呈 性;
CuCl2 , 溶液呈 性。
参考答案:CO32-+H2O=HCO3-+OH-,碱; &#
本题解析:
试题解析:K2CO3是强碱弱酸盐,水解后水溶液都呈碱性,水解离子方程式为 CO32-+H2O=HCO3-+OH-;Na2SO4是强酸强碱盐,不水解,溶液呈中性;CuCl2是强酸弱碱盐,水解后溶液呈酸性,水解离子方程式为:Cu2++2H2O=Cu(OH)2+2H+.
考点:盐类水解的规律
本题难度:一般
5、选择题 T℃时,某浓度醋酸钠溶液的pH=10,下列说法一定正确的是
A.溶液中由水电离出的OH一离子浓度c(OH一)=1×10一10mol/L
B.溶液中存在:c(H+)·c(OH一)=l×10-14(mol/L)2
C.溶液中存在:c(Na+)>c(CH3COO一)>c(OH一)>c(H+)>c(CH3COOH)
D.溶液中存在:c(CH3COOH)+c(CH3COO一)=c(Na+)
参考答案:D
本题解析:
试题分析:溶液的pH=10,c(H+)=l×10-10; 由于醋酸钠是强碱弱酸盐H+与CH3COO一发生反应而消耗,所以c(OH一)>1×10一10mol/L,错误;B.由于温度不是室温,所以溶液中存在:c(H+)·c(OH一)不一定是l×10-14(mol/L)2,错误;C.由于CH3COO一水解消耗,所以溶液中c(Na+)>c(CH3COO一),c(OH一)>c(H+);但是溶液中c(CH3COOH)>c(H+),所以离子浓度关系是:c(Na+)>c(CH3COO一)>c(OH一) >c(CH3COOH) >c(H+),错误;D.根据物料守恒可知,在溶液中存在:c(CH3COOH)+c(CH3COO一)=c(Na+),正确。
考点:考查溶液中离子浓度大小比较的知识。
本题难度:一般