微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2A(g)+B(g)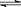 3C(g)+4D(g)的反应,不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,不同条件下的反应的速率最快的是
A.ν (A)=0.7mol·L-1·min-1???????????????????????????????????????????B.ν(B)=0.3 mol·L-1·min-1
C.ν(C)=0.9 mol·L-1·min-1????????????????????? D.ν(D)=1.0mol·L-1·min-1
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4 mol·L-1H2SO4 / mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和CuSO4溶液 / mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O / mL
| V7
| V8
| V9
| 15
| 10
| 0
请完成此实验设计,其中:V2 V5 = , V6= ,V8= ;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
组别
| c(HA)/mo1·L-1
| c(NaOH)/mo1·L-1
| 混合液pH
| 甲
| c
| 0.2
| pH = 7
| 乙
| 0.2
| 0.1
| pH>7
| 丙
| 0.1
| 0.1
| pH = 9
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ? (选填“是”或“否”)。
(5)分析乙组实验数据,HA是 酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是 。
(6)丙组所得混合液中由水电离出的c(OH-) = mo1·L-1。
参考答案:(14分)
 本题解析:(1) 本题解析:(1)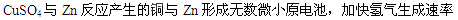
(2)加快化学反应的速率的因素有:升高温度、加入催化剂、增大压强(有气体参加的反应)、增大反应物的浓度、反应物的接触面积大小等,本题可采用的措施有:

(3)该实验的目的为:研究硫酸铜的量对氢气生成速率的影响,所以所取硫酸的量就是相同的,即V2=V5 =30;
由所加饱和CuSO4溶液的数据分析可得:V6=10;比较D、E、F中饱和CuSO4溶液的体积与所加水的体积分析可知,饱和CuSO4溶液的体积与加入水的体积和为20,进而求得V8=19.5;
(4)对于甲组来说,溶液的pH = 7为中性溶液,但无法确定c是否一定等于0.2,HA可以为弱酸,也可以为强酸;
(5)由乙组数pH>7,溶液呈碱性,且在等体积混合的情况下,HA的浓度又是NaOH溶液的2倍,即可得HA一定为弱酸。该混合体系中,溶液中的溶质为等物质的量的HA、NaA,
溶液中的离子成分为:Na+、A-、H+、OH-四种成分,由于溶液呈碱性,即以A-水解为主HA电离为次,所以溶液中各离子浓度的大小关系为:c(Na+)>c(A-)>c(OH-)>c(H+)
(6)丙组为等体积等物质的量浓度的一元酸与一元碱混合,混合后溶液中的溶质为NaA,因溶液的pH = 9,即HA为弱酸,A-水解使溶液呈碱性,促进水的电离。水电离出的c(OH-) =10-5
本题难度:简单
3、选择题 下列措施对增大反应速率明显有效的是?
[???? ]
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大反应器体积
D.Al在氧气中燃烧时,将Al片改成Al粉
参考答案:D
本题解析:
本题难度:一般
4、选择题 在100 ℃时,将0.40 mol二氧化氮气体充入2 L密闭容器中,每隔一段时间对该容器内
的物质进行分析,得到如下数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
| n(NO2)/mol
| 0.40
| n1
| 0.26
| n3
| n4
| n(N2O4)/mol
| 0.00
| 0.05
| n2
| 0.08
| 0.08
?
下列说法中正确的是(??)
A.反应开始20 s内以二氧化氮表示的平均反应速率为0.001 25 mol·L-1·s-1
B.80 s时混合气体的颜色与60 s时相同,比40 s时的颜色深
C.80 s时向容器中加入0.32 mol氦气,同时将容器扩大为4 L,则平衡将不移动
D.若起始投料为0.20 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
参考答案:D
本题解析:发生反应2NO2(g)  ?N2O4(g),前20 s内v(N2O4)= ?N2O4(g),前20 s内v(N2O4)=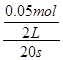 =0.001 25 mol·L-1· =0.001 25 mol·L-1·
本题难度:一般
5、选择题 在2A(g)+B(g)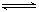 3C(g)+4D(g)中,表示该反应速率最快的是( ) 3C(g)+4D(g)中,表示该反应速率最快的是( )

 A.υ(A) = 0.5 A.υ(A) = 0.5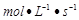 B.υ(B) = 0.3 B.υ(B) = 0.3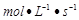
 C.υ(C) = 0.8 C.υ(C) = 0.8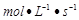 D.υ(D)= 1 D.υ(D)= 1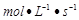
参考答案:B
本题解析:同一化学反应,用不同的物质表示其反应速率时,数值可能不同,但表示的意义是相同的,而且速率之比是相应的化学计量数之比。所以要要比较速率大小,应该换算成用同一种物质来表示,然后才能直接比较数值大小。若都用A表示,则选项B。C、D中速率分别为0.6mol/(L·s)、0.533 mol/(L·s)、0.5 mol/(L·s)。因此答案是B。
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772