微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 过氧化钙晶体(CaO2·8H2O)呈白色,微溶于水,加热至350℃左右开
始分解放出氧气。过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供
氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再
用纯的碳酸钙制取过氧化钙,其主要流程如下:
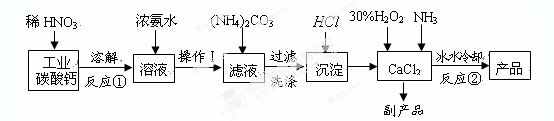
回答下列问题:
整个流程中涉及的化学反应属于氧化还原反应的有?????个,请写出其中任意一个的离子方程式:????????????????????????????????;
(2)反应②生成CaO2·8H2O的化学反应方程式为???????????????????????????????????;
反应时用冰水冷却的主要原因是????????????????????????????????????????;
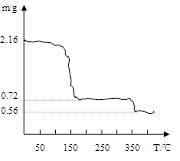
(3)将过氧化钙晶体在坩埚中加热并逐渐升高温度。测得样品质量随温度的变化如图曲线所示,则350℃以后所得固体物质的化学式为??????????????????????????????????。
参考答案:
(1)3FeCO3+10H++NO3-=3Fe3++
本题解析:
试题分析:(1)只有反应①中的FeCO3与硝酸反应是氧化还原反应,反应为
3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O
(2)该反应的反应物为CaCl2、H2O2、NH3,故方程式为CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O+2NH4Cl
因为H2O2受热易分解,故采用冰水冷却的方式防止其分解,提高利用率,同时温度低能较低溶解度,提高产率。
(3)在加热过程中固体中钙元素的量不变,固体由2.16g加热到350℃变为0.56g,
n(Ca)="2.16÷216=0.01mol" ?????m(CaO) =0.01×56=0.56g???故该固体为CaO
(这样的解法是一种猜测,该题可以先计算失去全部结晶水时质量,再由此计算质量差得出化学式)
本题难度:一般
2、选择题 下列过程中,涉及化学变化的是[???? ]
A.蒸馏法将海水淡化为饮用水
B.四氯化碳萃取碘水中的碘
C.过滤除去粗盐中的不溶性杂质
D.三氯化铁溶液滴入沸水中制胶体
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列实验装置通常不用于物质分离提纯的是
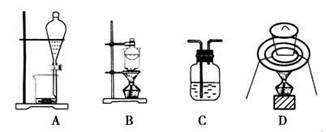
参考答案:D
本题解析:本题考查了化学实验中的物质的分离提纯,意在考查考生的实验能力及分析解决问题的能力。A项装置适用于萃取、分液;B项装置适用于两种固体混合物(其中一种是易升华物质)的分离;C项装置适用于混合气体的除杂、分离和提纯;D项装置主要用于灼烧固体物质,不能用于物质的分离提纯,D项符合题意。
本题难度:一般
4、填空题 选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法??????? B加热分解法????? C结晶法??
D分液法??????????? E蒸馏法????????? F过滤法
⑴??????分离饱和食盐水与沙子的混合物。
⑵??????从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
⑶??????分离水和汽油的混合物。
⑷??????从溴的水溶液里提取溴。
参考答案:⑴?? F?? ⑵ C?????。⑶? D???? ⑷??
本题解析:
试题分析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,因此从从溴的水溶液里提取溴的方法是萃取分液法;结晶法适用于不同溶质的溶解度受温度影响不同而分离的一种方法,因此从硝酸钾和氯化钠的混合溶液中获得硝酸钾的方法是结晶法;分液适用于互不相溶的液体之间的一种分离方法,因此分离水和汽油的混合物的方法是分液法;蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法,即分离饱和食盐水与沙子的混合物的方法是就是过滤法。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是明确原理,选准方法,灵活运用即可。该类试题需要明确的是分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下: ①分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解),溶解,过滤(洗涤沉淀),蒸发,结晶(重结晶);②分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏;③分离提纯物是胶体:盐析或渗析;④分离提纯物是气体:洗气。
本题难度:一般
5、填空题 硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下:

已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式?????????????????????????????、??????????????????????????????????。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是???????????????????????????????。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是????????????(填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是????????????????????????????????????。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去??????????????????????????????。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为???????????????????????????????????????????。
参考答案:(1)PbO+2H+=Pb2++H2O?(2分);
3
本题解析:
试题分析:(1)PbO与硝酸发生非氧化还原反应,离子方程式为PbO+2H+=Pb2++H2O;Pb与硝酸发生氧化还原反应,有NO气体放出,离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O?;
(2)Pb的活泼性比Ag强,Ag也可与硝酸反应,所以使Pb稍有剩余目的是防止Ag被溶解进入溶液(或使Ag留在浸出渣中);
(3)硫酸铅不溶于硝酸,所以硝酸铅与硫酸发生复分解反应,生成硫酸铅和硝酸,因此母液的主要溶质是HNO3;若母液中残留的SO42-过多,则在步骤Ⅰ中就有硫酸铅沉淀生成,随浸出渣排出,降低PbSO4的产率;
(4)浸出液中除含硝酸铅外还有硝酸钙,与硫酸反应有微溶的硫酸钙生成,所以洗涤的目的是除去CaSO4杂质;
(5)充电时铅蓄电池相当于电解池,阴极是硫酸铅发生还原反应生成Pb单质,电极反应式为PbSO4+2e-=Pb+SO42-?。
本题难度:一般