6. 4
?
某研究性学习小组欲用粗制硫酸锌溶液(其中含有Fe2+、Cu2+等)制备出活性ZnO,然后再合成葡萄糖酸锌。实验室制备活性ZnO的步骤如下:
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至?????(填写范围),除去溶液中Fe元素。
②加入?????,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液。
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生。写出该反应的离子方程式:?????。
④过滤、洗涤,将沉淀灼烧得活性氧化锌。其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、?????等。
参考答案:
(1)取少量溶液于试管,滴加BaCl2溶液,若产生白
本题解析:
试题分析:检验SO42—一般用盐酸和BaCl2溶液,要有取样、操作、现象、结论等步骤;(2)溶液酸性可以抑制Zn2+的水解;氧化锌与葡萄糖酸电离出氢离子反应,促进平衡正向移动,其它能与氢离子反应,不溶解于水、同时不产生新杂质的均可,如Zn(OH)2、ZnCO3等;(3)电解质一般不易溶解于有机溶剂,加入酒精能降低葡萄糖酸锌的溶解度,有利于其结晶析出;(4)①加入适量的KMnO4溶液把Fe2+氧化为Fe3+,调节pH让Fe3+沉淀完全,但不能Cu2+使沉淀,故范围为3.2~5.2;②加入过量锌除去C
本题难度:困难
3、选择题 下列解释实验事实的方程式不正确的是
A.0.1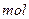 /L /L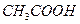 溶液的PH>1: 溶液的PH>1: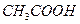 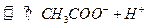
B.“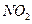 球”浸泡在冷水中,颜色变浅2 球”浸泡在冷水中,颜色变浅2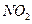 (g) (g)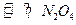 (g)△H<0 (g)△H<0
(红棕色)(无色)
C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2N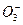  3Fe2++2NO↑+4H2O 3Fe2++2NO↑+4H2O
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红: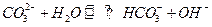
参考答案:C
本题解析:略
本题难度:一般
4、选择题 下列各组物质的物质的量浓度和体积相同,混合后pH大于7的是()
A.BaCl2、NaNO3、NH4Cl
B.K2CO3、HCl、CaCl2
C.Na2CO3、HNO3、HCl
D.K2S、KCl、HCl
参考答案:BD
本题解析:等物质的量浓度、等体积混合后,B、D中分别生成 和HS-,二者水解均呈碱性。而A呈酸性,C呈中性。 和HS-,二者水解均呈碱性。而A呈酸性,C呈中性。
本题难度:简单
5、选择题 (6分)现有浓度均为0.1? mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中水电离出的H+浓度由大到小的顺序是(填序号)_________
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________
(3)将①和⑧等体积混合后,混合液中各离子浓度关系正确的是________
A.c(H+)>c(SO42—)>c(NH4+)>c(OH-)
B.c(H+)=c(SO42—)=c(NH4+)>c(OH-)
C.c(NH4+)>c(H+)=c(SO42—)>c(OH-)
D.c(OH-)>c(H+)>c(NH4+)=c(SO42—)
参考答案:(1) ④> ②>③ > ①???? (2
本题解析:酸碱抑制水的电离,酸中由水电离的氢离子浓度等于氢氧根的浓度,碱中由水电离出的氢离子浓度等于KW/C(OH-).0.1? mol/L的硫酸c(H+)=0.2 mol/L,c(OH-)水=5×10-14 mol/L
氯化铵的溶液中氢离子的浓度都由水电离得到。0.1? mol/L的醋酸c(H+)<0.mol/L,c(OH-)水=c(H+)水>10-13mol/L.0.1? mol/L的?氢氧化钠c(OH-)=0
本题难度:一般
|