微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中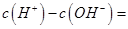 _________ (填字母编号)。
_________ (填字母编号)。

(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。
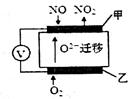
①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)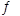 CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:

①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
参考答案:(18分)
(1)SO2+NH3+H2O===NH4+
本题解析:
试题分析:(1)相同物质的量的SO2与NH3溶于水生成NH4HSO3,所以离子方程式为:SO2+NH3+H2O===NH4++HSO3-;根据电荷守恒可得:c(H+)+c(NH4+)=c(OH?)+c(HSO3?)+2c(SO32?),所以c(H+)—c(OH?)= +c(HSO3?)+2c(SO32?)—c(NH4+),根据物料守恒可得:c(NH4+)+c(NH3?H2O)=c(HSO3?)+c(H2SO3)+c(SO32?),与电荷守恒式相减可得:c(H+)—c(OH?)=c(SO32?)+c(NH3?H2O)—c(H2SO3),故答案为BD。
(2)①根据O22?移动方向可知乙为原电池的正极,发生还原反应。
②根据示意图可知NO在甲电极上与O2?反应生成NO2,电极方程式为:NO-2e-+O2-===NO2。
(3)①对比实验I与实验II数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故?H < 0。
②根据表中650℃时数据可知:H2O(g)+CO(g)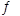 CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol?L?1) 1 2 0 0
转化浓度(mol?L?1) 0.8 0.8 0.8 0.8
平衡浓度(mol?L?1) 0.2 1.2 0.8 0.8
则650℃时平衡常数K=0.8×0.8/(0.2×1.2)=2.67,充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,浓度商Q==0.5×1/(1×0.5)="1" < K,所以开始时反应向正反应方向进行。
③根据表中反应II的数据,CO、H2O的转化量为0.4mol,则反应III的转化量也是0.4mol,所以平衡时a=1mol—0.4mol=0.6mol;实验II中H2O的初始量为1mol、CO的初始量为2mol,实验III中H2O的初始量为2mol、CO的初始量为1mol,所以实验IIH2O的转化率大于实验III。
考点:本题考查离子浓度比较、原电池原理、化学平衡常数、化学平衡。
本题难度:困难
2、选择题 在高温、高压和催化剂条件下的密闭容器中,进行反应:N2(g)+3H2(g)?2NH3(g),下列有关说法不正确的是( )
A.达到平衡时,正反应速率等于逆反应速率
B.增大氢气的浓度可增大反应速率
C.在上述条件下,氢气能全部转化为氨气
D.达到平衡时,体系中各物质的浓度不再改变
参考答案:A.达到平衡时,正反应速率等于逆反应速率,此为平衡状态的决定
本题解析:
本题难度:简单
3、选择题 在一定温度下,反应A2(g)+B2(g)  2AB(g)达到反应限度的标志是
2AB(g)达到反应限度的标志是
A.容器内气体的总压强不随时间变化而变化
B.A2和B2物质的量之和与AB的物质的量相等
C.c(A2):c(B2):c(AB)=1:1:2
D.A2、B2和AB的物质的量不再改变
参考答案:D
本题解析:
试题分析:A、该反应前后气体的系数相等,气体的总压强为定值,所以容器内气体的总压强不随时间变化而变化不能说明达到反应限度,错误;B、反应是否达到反应限度,与A2和B2物质的量之和与AB的物质的量是否相等无关,错误;C、反应是否达到反应限度,与各物质的浓度之比无关,错误;D、A2、B2和AB的物质的量不再改变,说明反应达到化学平衡状态,即达到反应限度,正确。
考点:本题考查化学平衡状态的判断。
本题难度:一般
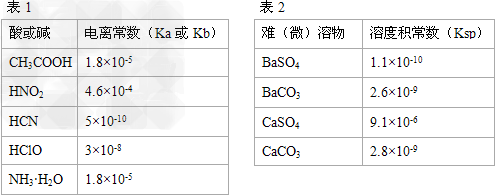
4、填空题 Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下,当弱电解质达到电离平衡时,溶液中已电离的电解质分子数占原电解质分子总数的百分数)和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
请回答下面问题:
⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度?????B.加水稀释???? C.加少量的CH3COONa固体???????D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-?)达到0.0l?mol/L以上,则溶液中c(CO32-?)应≥_______?mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)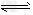 CH3CH2OH(g)+3H2O(g)??△H=a?kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g)??△H=a?kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
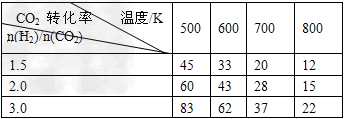
根据表中数据分析:
①上述反应的?a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2)?)比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:
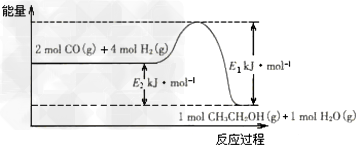
①写出CO和H2制备乙醇的热化学反应方程式_________________。
②在一定温度下,向上述密闭容器中加入1?mol?CO、3?mol?H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q?kJ,若温度不变的条件下,向上述密闭容器中加入4?mol?CO、
12?mol?H2及固体催化剂,平衡时,反应产生的热量为w?kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。
参考答案:Ⅰ⑴B;⑵中性;水电离出的H+和OH-的浓度相等,CH3CO
本题解析:
本题难度:困难
5、选择题 4、在体积固定不变的密闭容器中,充入2molNO和1molO2,在一定条件下达到平衡时,NO的转化率为95%,此时容器内的压强与开始时的压强之比是:
A.等于2.05/3
B.小于2.05/3
C.大于2.05/3
D.等于2/3
参考答案:B
本题解析:
试题分析: 2NO + O2 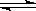 2NO2
2NO2
始 2mol 1mol 0
转 1.9mol 0.95mol 1.9mol
平 0.1mol 0.05mol 1.9mol
压强比= =
= =
=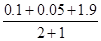 =
=
但由于该反应为可逆反应,所以小于2.05/3
考点:转化率的计算
点评:本题要弄清楚什么是可逆反应,以及简单的计算,要掌握可逆反应的特点。
本题难度:一般