微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,且气体体积为标况体积):
时间(min)
| 1
| 2
| 3
| 4
| 5
|
氢气体积(mL)
| 50
| 120
| 232
| 290
| 310
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_____???????????????______,
原因是?????????????????????????????????????。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)????????????
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体
积的下列溶液,你认为可行的是__________。
A.蒸馏水?? B.NaCl溶液?? C.NaNO3溶液?? D.CuSO4溶液?? E.Na2CO3溶液
2、填空题 (6分)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快,_____段收集的二氧化碳气体最多。
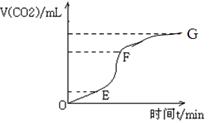
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
????????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是??
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
3、填空题 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。 请认真观察下图,然后回答问题。
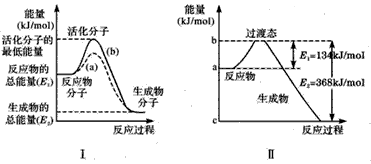
(1)图中所示的反应是____(填“吸热”或“放热”)反应,该反应___(填“需要”或“不需要”)加热,该化学反应的反应热△H=___(用含反应物的总能量E1、生成物的总能量E2的代数式表示反应热)。
(2)已知热化学方程式:H2(g)+0.5O2(g)==H2O(g) △H= -241. 8kJ/mol,该反应的活化能为167. 2kJ/ mol,则其逆反应的活化能为____。
(3)对于同一反应,图I中虚线a与实线b相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是____。
(4)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过,简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和 CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________。
4、选择题 100 mL 6 mol·L-1的硫酸溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2CO3固体
B.3 mol·L-1的H2SO4溶液
C.CH3COOK溶液
D.KNO3溶液
5、选择题 温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g) C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( ) C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间
| 0
| 5 min
| 10 min
| 15 min
| 20 min
| 25 min
| 30 min
| A的物质的量浓度(mol·L-1)
| 3.5
| 2.3
| 2.0
| 2.0
| 2.8
| 3.0
| 3.0
| B的物质的量浓度(mol·L-1)
| 2.5
| 1.3
| 1.0
| 1.0
| 1.8
| 2.0
| 2.0
| D的物质的量浓度(mol·L-1)
| 0
| 2.4
| 3.0
| 3.0
| 1.4
| 1.0
| 1.0
?
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=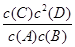
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
|
|