310
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_____???????????????______,
原因是?????????????????????????????????????。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)????????????
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体
积的下列溶液,你认为可行的是__________。
A.蒸馏水?? B.NaCl溶液?? C.NaNO3溶液?? D.CuSO4溶液?? E.Na2CO3溶液
参考答案:①2-3min?反应放热,温度升高,反应速率加快
②0
本题解析:
试题分析:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别是:50 mL、 70mL 、112mL、68mL、20 mL,由此知反应速率最大的时间段为2-3min;反应速率刚开始增大后来又逐渐减小与反应物的浓度无关,只能是与反应的热效应有关。
(2)在2~3分钟时间段内,n(H2)= 0.112L/22.4L/moL=0.005mol,则消耗盐酸的物质的量=2n(H2),则υ(HCl)=0.1mol/(L·min)。
(3)A、加入蒸馏水,H+浓度减小,
本题难度:一般
2、填空题 (6分)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快,_____段收集的二氧化碳气体最多。
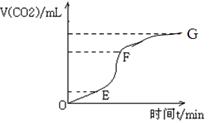
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
????????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是??
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
参考答案:(1)EF;EF??(2)OE 时间段,开始盐酸浓度较大,故
本题解析:(1)化学反应速率是用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示,改变量越多,反应速率越快。由图像可知,EF段,单位时间内CO2的生成量最多,反应速率最快。
(2)OE 时间段,开始盐酸浓度较大,故反应较快,EF时间段,由于该反应放热,随着反应进行,反应体系温度升高,反应速率加快,FG时间段,盐酸浓度变小,反应速率变小。
(3)减缓反应速率可采用降低反应物浓度、降低反应温度、减小固体表面积等措施。AC正确,B不影响,D是最大反应速率,答案选AC。
本题难度:一般
3、填空题 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。 请认真观察下图,然后回答问题。
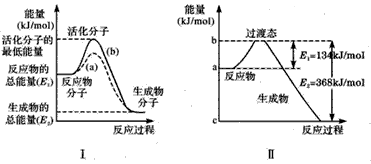
(1)图中所示的反应是____(填“吸热”或“放热”)反应,该反应___(填“需要”或“不需要”)加热,该化学反应的反应热△H=___(用含反应物的总能量E1、生成物的总能量E2的代数式表示反应热)。
(2)已知热化学方程式:H2(g)+0.5O2(g)==H2O(g) △H= -241. 8kJ/mol,该反应的活化能为167. 2kJ/ mol,则其逆反应的活化能为____。
(3)对于同一反应,图I中虚线a与实线b相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是____。
(4)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过,简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和 CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________。
参考答案:(1)放热;需要; -(E1-E2)kJ/mol
(
本题解析:
本题难度:一般
4、选择题 100 mL 6 mol·L-1的硫酸溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2CO3固体
B.3 mol·L-1的H2SO4溶液
C.CH3COOK溶液
D.KNO3溶液
参考答案:C
本题解析:此反应实质是2H++Zn Zn2++H2↑,又因为要求不影响生成氢气的总量,因此不能改变H+的物质的量。加Na2CO3溶液,会生成CO2,影响生成H2的总量,故A项错;加入3 mol·L-1的H2SO4溶液,会生成更多H2,故B项错;加入KNO3溶液,Zn与H+、N反应生成NO,减少了H+的物质的量,影响氢气的生 Zn2++H2↑,又因为要求不影响生成氢气的总量,因此不能改变H+的物质的量。加Na2CO3溶液,会生成CO2,影响生成H2的总量,故A项错;加入3 mol·L-1的H2SO4溶液,会生成更多H2,故B项错;加入KNO3溶液,Zn与H+、N反应生成NO,减少了H+的物质的量,影响氢气的生
本题难度:一般
5、选择题 温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g) C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( ) C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间
| 0
| 5 min
| 10 min
| 15 min
| 20 min
| 25 min
| 30 min
| A的物质的量浓度(mol·L-1)
| 3.5
| 2.3
| 2.0
| 2.0
| 2.8
| 3.0
| 3.0
| B的物质的量浓度(mol·L-1)
| 2.5
| 1.3
| 1.0
| 1.0
| 1.8
| 2.0
| 2.0
| D的物质的量浓度(mol·L-1)
| 0
| 2.4
| 3.0
| 3.0
| 1.4
| 1.0
| 1.0
?
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=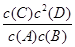
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
参考答案:B
本题解析:A项中,0~10 min,D的物质的量浓度的变化量是3.0 mol·L-1,所以平均反应速度v(D)=3.0 mol·L-1÷10 min=0.3 mol·L-1·min-1,A正确;B项中,因为根据化学反应方程式知C为固体,所以平衡常数表达式中不应含有C物质,B不正确;C项中,根据表格中的数据知15 min时A、B的物质的量浓度均变化了1.5 mol·L-1,D的物质的量浓度变化了3.0 mol·L-1,A、D的物质的量浓度变化量之比为1∶2,所以x=2,该反应在反应前后气体分子数相等,改变容器体积对平
本题难度:一般
|
|