微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
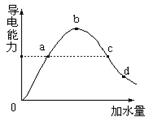
(1)加水前导电能力为零的理由是:?????????????????????????????????????????
(2)a、b、c、d四点醋酸的电离度大小顺序是??????????????????????????????????
(3)a、b、c、d四点溶液PH值大小顺序是????????????????????????????????????
(4)若要把b点溶液中(CH3COO-)、(OH-)均减小,可采用的方法是 (选择正确的选项)??????
A.加水
B.加NaOH
C.加H2SO4
D.加Na2CO3
参考答案:(1)答:冰醋酸中没有自由离子(2)答:d>c>
本题解析:略
本题难度:一般
2、填空题 (6分)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH变化曲线如下图所示(忽略温度变化)。请回答下列有关问题:
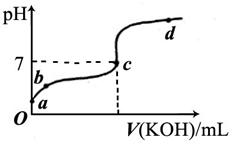
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度的大小顺序可能有 种情况。
(3)a、b、c三点中水的电离程度最大的是 。
参考答案:(1)4×l0-4 本题解析:
本题解析:
试题分析:(1)K=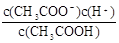 ,溶液中的c(CH3COO-)=c(H+),所以c(H+)=
,溶液中的c(CH3COO-)=c(H+),所以c(H+)= =4×l0-4
=4×l0-4  。
。
(2)b点溶液呈酸性,则可能是c(CH3COO-)>c(H+)>c(K+)>c(OH-)或c(CH3COO-)>c(K+))>c(H+)>c(OH-)或c(CH3COO-)>c(H+)=c(K+)>c(OH-)三种情况。
(3)酸或碱抑制水的电离,有弱的盐促进水的电离,所以c点水的电离程度最大。
考点:弱电解质的电离
点评:本题难度较大,由电离平衡常数求c(H+)时,要注意忽略已电离的酸。
本题难度:一般
3、选择题 25 ℃时,a mol·L一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b
B.a>b
C.c(A-)=c(Na+)
D.c(A-)<c(Na+)
参考答案:C
本题解析:假如酸是强酸,则酸和碱恰好反应显中性,其物质的量应该相等,,即体积相等时,a=b;假如酸为弱酸,pH=7,酸应该过量,体积相等时,a>b;故,A、B错;要显中性,c(H+)=c(OH-),根据电荷守恒,则c(Na+)=c(A-),D错;答案选C。
本题难度:一般
4、选择题 向0.1 mol/L的氨水溶液中加水稀释或加入少量NH4Cl固体时均会引起变化的是
[???? ]
A. 溶液的导电能力减弱
B. 溶液的pH变小
C. NH3·H2O的电离度变大
D. Kw(水的离子积常数)变大
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若 LpH=11的NaOH溶液与
LpH=11的NaOH溶液与 LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则 ≤
≤
参考答案:C
本题解析:
试题分析:A、将pH=4的盐酸稀释后,溶液中氢离子和氯离子的浓度降低,但温度不变,Kw不变,氢氧根离子的浓度升高,错误;B、0.l0mol·L-1的氨水加水稀释后,虽然一水合氨的电离平衡正向移动,但由于溶液体积的增大起主要作用,溶液中c(NH4+)、c(OH-)变小,错误;C、Na2CO3水解呈碱性,常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变,正确;D、V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,若HA为强酸,则V1=V2,若HA为弱酸,则V1
本题难度:一般