微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
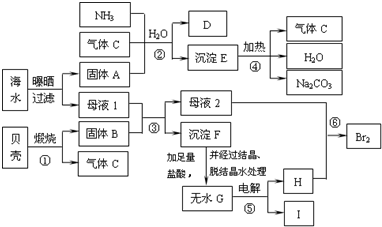
1、简答题 利用海水等可制得多种化工产品.下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中D是一种氮肥,H为黄绿色气体,I是一种单质,其原子K层和M层电子数相同.
试填写下列空白:
(1)F的化学式为______;
(2)在①~⑥反应中属于氧化还原反应的是(填序号)______;
(3)上述过程可以得到哪些化工产品(写出3种)______;
(4)将H通入母液2中置换得到的Br2的浓度很小,需要进行富集,方法是:用空气将Br2吹出,用纯碱溶液吸收,最后用稀硫酸酸化,即可得到Br2.纯碱溶液吸收Br2的离子方程式为:3Br2+3CO32-═BrO3-+5Br-+3CO2↑,试写出用稀硫酸酸化得到Br2的离子方程式______.
2、简答题 工业“从海水中提取镁”的流程图如图所示: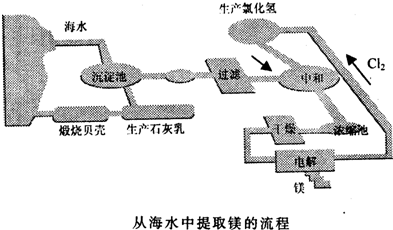
步骤为:
①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O;
④将MgCl2?6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg.
(1)步骤①中涉及的化学方程式为______.
(2)步骤③中的蒸发利用风吹日晒完成,但在实验室中蒸发操作时需要的主要仪器有______、______、酒精灯、三角架等.
(3)海水中的镁以Mg抖形式存在,设计步骤②③将Mg2+转化为Mg(OH)2又重新转化为Mg2+的目的是______.
(4)步骤④中的“一定条件”指的是______,目的是______.
(5)上述流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
(6)有同学认为:可以在步骤②后加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,以简化实验步骤,体现实验的简约性原则.你是否同意该同学的观点______(填“同意”或“不同意”),理由为______.
3、简答题 镁是一种性质活泼、用途广泛的金属,研究镁的冶炼性质对于生产、生活意义重大.
(一)目前世界上60%的镁是从海水中提取的.已知从海水中提炼镁的主要步骤如图:
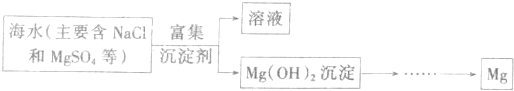
学生结合这个课题提出了以下问题:
(1)从海水中提取镁的过程中如何实现对镁的富集?
学生1的观点:直接往海水中加入沉淀剂.
学生2的观点:高温加热蒸发海水后,再加入沉淀剂.
学生3的观点:利用上述海水晒盐后剩余的溶液,加入沉淀剂.
请你评价三个学生提出的观点是否合理(填“是”或“否”),若不合理请简述理由.
| 观点 | 是否正确 | 简述理由
学生1
否
______
学生2
______
______
学生3
______
______
(2)从海水中提镁的过程中如何实现对镁的分离?
①过程中所用沉淀剂的制造原料也来源于海洋,则该沉淀剂是______(填化学式).
②试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼镁的方法是______(填选项字母).
A.Mg(OH)2△
MgO电解
2800℃
Mg
B.Mg(OH)2△
MgOC真空
1352℃
Mg
C.Mg(OH)2①过量盐酸
②△
无水MgCl2
网站客服QQ: 960335752 - 14613519 - 791315772
|