微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 加Al能产生H2的溶液中,一定可以大量共存的是
A.Na+、NO3-、Cl-、Mg2+
B.NH4+、K+、Cl-、ClO-
C.NH4+、K+、Cl-、SO3?2-
D.Cl?-、Na+、K+、SO42-
参考答案:D
本题解析:分析:加Al能产生H2的溶液,为酸或强碱溶液,根据离子之间不能结合生成水、气体、沉淀,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答:加Al能产生H2的溶液,为酸或强碱溶液,
A.酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,碱溶液中OH-、Mg2+结合生成沉淀,不能共存,故A错误;
B.酸溶液中H+、Cl-、ClO-发生氧化还原反应,碱溶液中OH-、NH4+结合生成弱电解质,不能共存,故B错误;
C.碱溶液中OH-、NH4+结合生成弱电解质,酸溶液中H+、SO32-结合生成水和气体,则不能共存,故C错误;
D.无论酸或强碱溶液中该组离子之间不反应,能共存,故D正确;
故选D.
点评:本题考查离子的共存,注意习题中的信息判断溶液的酸碱性为解答的前提,侧重氧化还原反应的考查,也为解答的难点,题目难度中等.
本题难度:困难
2、填空题 (7分)反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
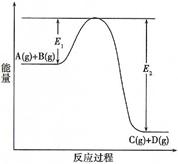
① 图中E1代表的意义是 。
该反应是 反应(填“吸热”、“放热”)。反应热△H的表达式为 。
② 当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”或“不变”)。
③ 在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2 (填“增大”、“减小”或“不变”)。化学平衡 移动(填“向左”、“向右”或“不”)。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
3、选择题 下列关于化学键的说法中正确的是
A.化学键是一种静电引力
B.化学键可以使离子结合,也可以使原子结合
C.只要有旧健的断裂就一定是化学反应
D.氢键是一种化学键
参考答案:B
本题解析:
试题分析:化学键是使原子或离子相结合的强烈作用力,B正确,A不正确;旧健的断裂,同时还有新的化学键形成,才是化学反应,C不正确。氢键不是化学键,D不正确,答案选B。
点评:该题是基础性试题的考查,难度不大。该题主要是考查学生对化学键概念的熟悉掌握程度,以及灵活运用化学键解决实际问题的能力。
本题难度:简单
4、选择题 下列过程中化学键未被破坏的是( )
A.干冰升华
B.溴与H2生成HBr
C.SO2气体溶于水
D.NaCl固体溶于水
参考答案:A、干冰升华,只是状态的变化,干冰的构成微粒是分子,气态的二
本题解析:
本题难度:一般
5、选择题 碘与氢气反应的热化学方程式为:
①I2(g)+H2(g)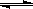 2HI(g) ΔH=" -" 9.48 kJ·mol-1
2HI(g) ΔH=" -" 9.48 kJ·mol-1
②I2(s)+H2(g)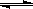 2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
A.反应①的产物比反应②的产物稳定
B.I2(s)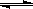 I2(g)ΔH=" +" 17.00 kJ·mol-1
I2(g)ΔH=" +" 17.00 kJ·mol-1
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol I2(g)中通入1 mol H2(g),反应后放热9.48 kJ
参考答案:C
本题解析:
试题分析:A、同一种物质在相同条件下,能量一样多,A错误;B、利用盖斯定律可得出1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ,B错误,C项正确;D、反应是可逆反应,反应物不能完全转化,放热达不到9.48 kJ,D错误。答案选C。
考点:考查化学反应热的计算。
本题难度:一般