13.7
就此实验回答:
(4)盐酸和氢氧化钠的反应是???????????(填“吸热”或“放热”)反应。
(5)请在图中绘制出溶液的温 度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。 度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
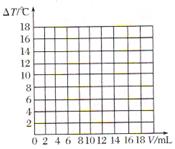 ????????????? ?????????????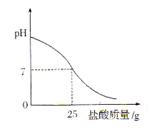
Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,pH测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系如图所示。
(6)请以此次测定的结果为依据计算该盐酸的实际质量分数为???????????????。
(7)请分析你的计算结果与标签标示的质量分数不一致的可能原因(若一致,此空可不填):?????????????????????????????????。
参考答案:Ⅰ.(1)酚酞,1~2滴;(2)①用干净的玻璃棒蘸取待测液滴
本题解析:略
本题难度:一般
2、实验题 (6分)下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器.铁架台.试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
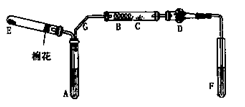
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号)???????。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是???????。
(3)写出B处的现象???????。
参考答案:(6分)(1)B.E.A.F。(2)将试管A放入78℃的热水
本题解析:乙醇催化氧化的实验原理:2CH3CH2OH+O2Cu/Ag△2CH3CHO+2H2O;所以
(1)加热的仪器先后顺序为:B、E、A、F,实验时应先加热铜丝使温度升高,再通入氧气生成氧化铜,再加热A产生乙醇蒸气;
(2)由于无水乙醇和沸点78℃比水低,为产生平稳的气流,常用水浴加热的方法加热。
(3)铜丝表面现象将会出现红、黑交替现象。其实质铜做为催化剂作用。
本题难度:简单
3、实验题 (9分)为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空:
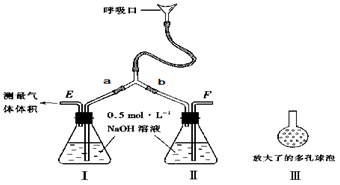
⑴图中瓶II的作用是______________________________。
⑵对实验装置尚有如下A、B、C、D四种观点,你认为合理的是________。(填代号)
A.在E处增加CaCl2干燥管 ?? B.在F处增加CaCl2燥管
C.在E和F两处增加CaCl2干燥管 D.不必增加干燥管
⑶将插入溶液的管子末端改成具有多孔的球泡(图中的III),有利于提高实验的准确度,???
其理由是__________________________________________。
⑷实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集到的气
体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式)?___________。
⑸为防止实验中若猛吸猛呼,会造成不安全后果,将实验装置如何改进?????????????。
参考答案:(1)除去吸人空气中的CO2(2分)
????(2)
本题解析:通过审题后思考清楚实验设计的原理才是解题的关键。首先要考虑到吸
入的气体不能引入二氧化碳,呼出的二氧化碳要充分被吸收,这样习题
的(1)、(2)、(3)三问就全部解答完整,根据装置的特点再进行改进。
本题难度:一般
4、实验题 (9分)某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如右图所示装置。实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余。

(1)为防止空气污染,请补画右图虚框中的实验装置,并注明所需要的试剂名称。
(2)写出铜跟浓硫酸反应的化学方程式:
??????????????????????????????????????????????????。
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
?????????????????????????????????????????????????????????????????。
(4)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的???????????(填写字母序号):
A.铁粉
B.BaCl2溶液
C.银粉
D.Na2CO3溶液
参考答案:
 本题解析:(1)为防止空气污染,应有尾气吸收装置, 本题解析:(1)为防止空气污染,应有尾气吸收装置,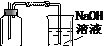
(2)写出铜跟浓硫酸反应的化学方程式:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
铜只与浓硫酸反应,随着反应的进行,浓硫酸变为稀硫酸,铜就不在反应,所以,溶液中肯定有稀硫酸存在。
(4)为证明反应结束后的烧瓶中确有余酸,可选用的药品是铁粉、Na2CO3溶液。加入铁粉,如果铁粉溶解并有气泡产生,证明有余酸。加入Na2CO3溶液,如果有气泡产生,证明有余酸。故选A D。
本题难度:简单
5、填空题 (10分)已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
一、初步探究
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)用????????????(填实验用品名称)取固体混合物于烧杯中。
(2)上述实验可以得到的初步结论是??????????????????????????????。
二、进一步探究
(3)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
实验操作
| 预期现象和结论
| ?
| ?
| ?
| ?
参考答案:
(1)药匙(1分)
(2)该混合物中肯定含有N
本题解析:(1)用药匙取固体混合物于烧杯中。
(2)固体物质加水溶解,得到无色透明溶液,肯定不含Cu2+,闻到有轻微的刺激性气味,说明含有NH4+,再滴加稀硝酸,有气泡产生,说明生成了CO2,由此可以得到的初步结论是混合物中肯定含有NH4HCO3,肯定不含有CuSO4。
(3)
实验操作
预期现象和结论
向溶液B中滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,(含有NaCl或NH4Cl。)
取少量原固体混合物于试管底部,(1分)??将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
本题难度:简单
|
|