微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (7分)实验室利用如图装置进行中和热的测定,请回答下列问题:
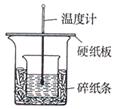
(1)在操作正确的前提下,提高中和热测定准确性的关键是?????
(2)做1次完整的中和热测定实验,温度计需使用??????????????????次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么????????????????????????????????????????
(3)请为本实验设计数据记录表格:
参考答案:(7分)(1)保温(1分)
(2)3次?(1分)不同意
本题解析:略
本题难度:一般
2、实验题 某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。
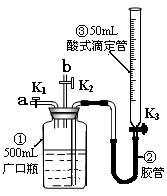
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作:???????????????;
②从导管a通入一定量的NO,并记录滴定管读数,求出液面变化的数值为VL(V<50mL,气体体积已换算为标准状况)。准确测定NO的体积的主要操作:?????????????????????;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是??,写出对应现象的化学反应方程式?????????、?????????????;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i?当通入氧气的体积为1/2V时,则广口瓶①的气体体积为???????????????;
ii 当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为?????????????mol/L。
参考答案:(每空2分)
(1)①打开K2、K3(或K1、K3或K
本题解析:略
本题难度:一般
3、实验题 根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
实验操作
| 预期现象和结论
|
步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。
| 有不溶的黑色固体。
|
步骤2:取适量步骤1清液于试管中,????
??????????????????????????????????????
| ??????????????????????????????????????
??????????????????????????????????????
|
步骤3:????????????????????????
????????????????????????????????
| ??????????????????????????????????????
??????????????????????????????????????
?
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行了以下实验:
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液。
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3―),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL。
步骤3:重复实验3次。滴定结果如下
滴定
次数
| 待测溶液
的体积/mL
| 消耗标准盐酸的体积
| V1/mL
| V2/mL
| 1
| 25.00
| 15.02
| 4.97
| 2
| 25.00
| 14.98
| 5.03
| 3
| 25.00
| 13.21
| 6.75
?
①步骤2中,第一步滴定所使用的A指示剂为???????????,滴定终点的现象为???????????????????????。
②计算Na2CO3的质量分数=?????????????????(用含w、c的代数式表示)
参考答案:
(1)
实验操作
预期现象与结论
本题解析:
试题分析:(1)Na2O+H2O=2NaOH,NaOH和Na2CO3都能与稀盐酸反应,因此不能滴加稀盐酸;Na2CO3与BaCl2、Ba(OH)2是都能反应生成白色沉淀,但是后者会引入NaOH,干扰产物中Na2O的检验,因此步骤2中只能滴加足量BaCl2溶液;充分振荡,有白色沉淀生成,说明产物中存在Na2CO3;静置,取上层清液于另外一支试管备用;由于室温时BaCO3饱和溶液的pH=9.6,如步骤2的上层清液中混有NaOH,则其pH>9.6,因此步骤3中应将一片精密pH试纸置于表面皿上,用玻璃棒蘸取步骤二上层清液点在精密pH试纸上,待颜色稳定后,对照比色卡读出数据,若溶液pH明显大于9.6说明产物中含有Na2O;(2)①步骤2中第一步滴定终点的pH约为8.2,刚好在酚酞的pH变色范围,因此选择酚酞作指示剂,当待测的碱性溶液由浅红色变成无色,且半分钟内不变色,这是滴定终点的现象,就停止滴定;②第3次滴定所得数据存在明显的误差,应舍去;根据第1、2次滴定所得体积计算平均体积,则V1=(15.02+14.98)mL/2=15.00mL,V2=(4.97+5.03)mL/2=5.00mL;由于第1次滴定时先后发生反应为NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl,则n(HCl)=n(NaOH)+n(Na2CO3)=cmol/L×15.00×10—3L、n(Na2CO3)=n(NaHCO3);第2次滴定时只发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,则n(HCl)=n(NaHCO3)=cmol/L×5.00×10—3L,所以n(Na2CO3)= n(NaHCO3)=cmol/L×5.00×10—3L,n(NaOH)= cmol/L×15.00×10—3L—cmol/L×5.00×10—3L = cmol/L×10.00×10—3L;式样中n(Na2CO3)=cmol/L×5.00×10—3L×250mL/25.00mL,n(NaOH)= cmol/L×10.00×10—3L×250mL/25.00mL;式样中m(Na2CO3)=cmol/L×5.00×10—3L×250mL/25.00mL×106g/mol,w(Na2CO3)=cmol/L×5.00×10—3L×250mL/25.00mL×106g/mol÷wg×100%=5.3c/w×100%。
本题难度:简单
4、填空题 某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原
例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
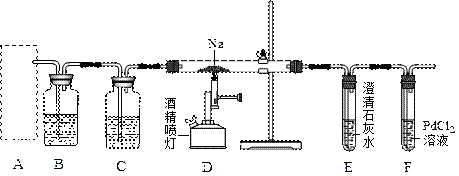
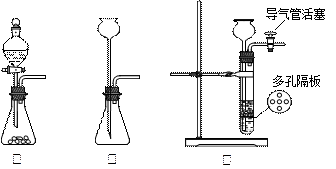
请回答下列问题:?
(1)通常实验室制取CO2气体的离子方程式是???????????????????????????????,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___??(填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是????????????溶液,装置C中应盛放的试剂是________??????。
(2)观察实验装置图可知Na与CO2反应的条件是_____________。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。待装置______(填写字母)中出现????????????????????现象时,再点燃酒精喷灯,这步操作的目的是??????????????????????????????????????。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是????????????????????????????????????????????????????????。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是??????????????????????????????????????????????????????????。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。??????????????????????????????????????????????????????????????????。
参考答案:
(1)CaCO3 + 2H+= Ca2+ + H2O
本题解析:略
本题难度:一般
5、实验题 在进行某实验探究过程中,一些学生发现等质量的铜片分别与等体积(均过量)的浓硝酸和稀硝酸反应,所得溶液前者为绿色,后者为蓝色。
针对这种现象,学生们进行了讨论后,出现了以下两种观点:
一种认为,这可能是Cu2+浓度的差异引起的。你同意这种看法吗?????(填“同意”或“不同意”),原因是????????????????????????????????????????????????。
另一种认为,呈“绿色”是Cu2+与NO2混合的结果。请你设计出一个实验方案证明之,你设计的实验方案是???????????????????????????????????????????
已知0.3mol Cu与足量的稀硝酸反应,则被还原的HNO3的物质的量是????mol。
参考答案:不同意(1分)?浓硝酸、稀硝酸均过量,Cu全部转化为Cu2+
本题解析:
试题分析:因溶液的颜色由有色离子的浓度来决定,而Cu2+浓度相同,颜色应该相同,故答案为:不同意; 浓硝酸、稀硝酸均过量,Cu全部转化为Cu2+,则在同体积的溶液中Cu2+浓度相同、溶液颜色应该相同。
因除去NO2若颜色变蓝,则是由于Cu2+与NO2混合的结果,故答案为:加水稀释看能否由绿色变为蓝色。
Cu与足量的稀硝酸反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,在这个方程式中我们可以知道有2mol硝酸被还原成NO,参加反应的硝酸与被还原的硝酸的物质的量之比是4:1,而0.3molCu和0.8molHNO3完全反应,所以硝酸物质的量为0.8mol,则被还原的HNO3物质的量是0.2mol。
点评:本题主要考查了铜与硝酸的反应,根据问题情景,运用所学知识来解决问题,培养了学生分析问题解决问题的能力,题目难度中等。
本题难度:一般
|
|