微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x的值。通过查阅资料该小组同学得知:草酸易溶于水,其水 溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+
溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+???2Mn2++10CO2↑+8H2O。该组同学利用该反应原理设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
滴定次数
| 待测草酸溶液体积(mL)
| 0.1000 mol/LKMnO4标准溶液体积(mL)
|
滴定前刻度
| 滴定后刻度
|
第一次
| 25.00
| 0.00
| 10.02
|
第二次
| 25.00
| 0.22
| 11.32
|
第三次
| 25.00
| 1.56
| 11.54
?
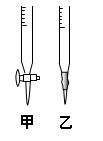
请回答:
(1)滴定时,将KMnO4标准液装在右图中的?????(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志可以是??????????????????????。
(3)通过上述数据,计算出x=?????????。
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会?????(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会??????。
参考答案:(1)甲
(2)最后一滴高锰酸钾滴入溶液突然出现紫色(
本题解析:略
本题难度:简单
2、实验题 (15分)广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) = 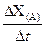 ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。 ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
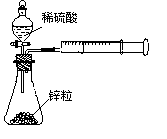
可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C 、350C
(1)请写出锌和硫酸反应的离子方程式??????????????????????????????????????????
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
编号
| 反应速率表达式的定义
| 反应速率表达式
| 反应速率单位
| ①
| 单位时间内H+浓度的变化量
| V(H+) =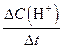
| mol / L.min
| ②
| 丁
| 戊
| 己
| ③
| 单位时间内生成H2标况下的体积
| V(H2) = 
| L / min
??
(3)该学习小组选用0.1 mol Zn和200 mL 1mol/L 稀硫酸(硫酸过量)在250C反应进行研究,用秒表计时,至锌块完全溶解且溶液中不再有气泡放出时,记录反应时间为5分钟,该反应速率V(H+) = ????????????
(4)该小组对“影响反应速率的因素”进行了分析,设计如下系列实验,庚辛壬癸四处空白。
编号
| 锌的形状
| 锌的规格
| 硫酸的浓度
| 反应温度
| 实验设计的目的
| ①
| 块状
| 纯锌
| 1mol/L
| 250C
| 实验①和②研究的目的是????庚??????;
实验②和③研究硫酸浓度对反应速率影响;
实验③和④研究锌的规格对反应速率影响;
实验④和⑤研究的目的是?????癸??????;
| ②
| 颗粒状
| 纯锌
| 1mol/L
| 250C
| ③
| 颗粒状
| 纯锌
| 辛
| 250C
| ④
| 颗粒状
| 壬
| 2mol/L
| 250C
| ⑤
| 颗粒状
| 粗锌
| 2mol/L
| 350C
| ……
参考答案:
(1)Zn + 2H+ = Zn2+ +H2↑??
本题解析:略
本题难度:简单
3、实验题 (13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为:
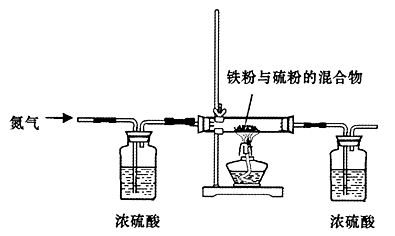
步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为FeS
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气。请写出该反应的离子方程式:?????????????????。
(2)实验中通入氮气的作用???????????????????。
(3)若猜想一正确,则步骤三应该观察到试管内有?????????出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论????????????????。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是???????????????????。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是?????????????????????????。
参考答案:(1)NH4+ + NO2-  本题解析:(1)氮元素发生了归中反应:NH4+ + NO2- 本题解析:(1)氮元素发生了归中反应:NH4+ + NO2-  ?N2↑+2H2O ?N2↑+2H2O
(2)防止铁粉或硫粉被氧气氧化
(3)固体溶液产生的铁离子与硫化氢生成硫单质:2Fe3++H2S=2Fe2++S↓+2H+,有淡黄色或乳白色浑浊出现
(4)也就是亚铁离子的检验(FeS+2H+=Fe2++H2S↑):
取步骤三所得溶液少许,滴加KSCN溶液,若溶液不显红色,再向溶液中滴加少量氯水,溶液显红色,证明原溶液中只含有Fe2+,则黑色固体中铁的化合价为+2价
(5)在步骤三中固体中加酸,需要通过对Fe2+的检验来判定FeS,而铁可以与酸产生Fe2+,所以必须使硫粉过量
(6)过量的硫可溶于碱液:3S+6OH-=S2-+SO32-+3H2O
本题难度:简单
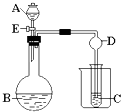
4、简答题 用右图所示装置进行实验,将A逐滴加入B中:
(1)若B为CaCO3,C为C6H5ONa溶液,实验观察到小试管内溶液变浑浊,则酸A比碳酸的酸性______(填“强”、“弱”).然后往烧杯中加入沸水,可观察到试管C中的现象是______.
(2)若A是浓氨水,B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则C是葡萄糖与______(写化学式)的混合液,该银镜反应的化学方程式为______,仪器D在此实验中的作用是______.
参考答案:(1)观察到小试管内溶液变浑浊,说明生成二氧化碳,则A的酸性
本题解析:
本题难度:一般
5、选择题 查阅资料发现,金属钠不仅能与氧气和水反应,还能与很多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠和酒精、金属钠和水反应的异同点,下列的研究方法中用不到的是(?)
A.观察法
B.分类法
C.实验法
D.比较法
参考答案:B
本题解析:
试题分析:研究金属钠和酒精、金属钠和水反应的异同点,可以采用的研究方法有观察法,即观察两者发生反应的剧烈情况; 实验法和比较法,即通过实验比较两者反应的剧烈情况,分类法对研究金属钠和酒精、金属钠和水反应的异同点没有意义,故本题的答案选择B。
点评:本题考查了化学探究过程中所采用的研究方法,所以对学生科研基本功的考查,该题比较简单。
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772