微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,正确的是???????????(???)
A.两种元素构成的共价化合物分子中的化学键都是极性键
B.含有非极性键的化合物分子一定不是极性分子
C.白磷晶体中,微粒之间通过共价键结合,键角为60°
D.金属晶体在熔化时,金属键被破坏,而原子晶体熔化时,共价键不被破坏
参考答案:D
本题解析:在H2O2中含有非极性键,A不正确。双氧水是极性分子,B不正确。白磷是分子晶体,微粒之间的作用力是分子间作用力,C不正确。所以正确的答案是D。
本题难度:一般
2、选择题 下列分子中键角最大的是
A.CH4
B.NH3
C.H2O
D.CO2
参考答案:D
本题解析:
试题分析:甲烷是正四面体型结构,键角是109°28′;氨气是三角锥形结构,键角是107°;水时V形结构,键角是105°;CO2是直线型结构,键角是180°,答案选D。
点评:该题是基础性试题的考查,难度不大。该题的关键是熟练记住常见分子的空间构型和键角大小,有利于调动学生的学习兴趣和学习积极性。
本题难度:简单
3、选择题 强酸与强碱的稀溶液发生中和反应的热效应:
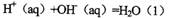
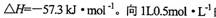 。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应
。向1L0.5mol的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应时的热效应 的关系正确的是
的关系正确的是

参考答案:D
本题解析:
试题分析:强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O△H=一57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸,醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时的放出的热量为②>③>①,所以△H1>△H2>△H3,选D。
考点:考查反应热的大小比较。
本题难度:一般
4、选择题 CH3COOH与C2H518OH发生酯化反应后生成酯的摩尔质量为
A.88 g·mol-1
B.86 g·mol-1
C.90 g·mol-1
D.92 g·mol-1
参考答案:C
本题解析:掌握酯化反应的断键特点.
本题难度:一般
5、填空题 (14分)NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
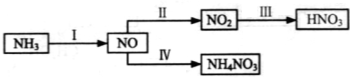
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
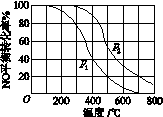
①比较p1、p2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
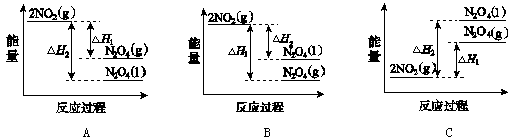
①已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
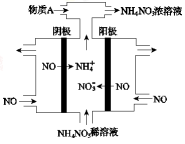
为使电解产物全部转化为NH4NO3,需补充A。A是 ,说明理由: 。
参考答案:(14分)
(1)4NH3+5O2 本题解析:
本题解析:
试题分析:(1)氨在催化剂的作用下与氧气反应生成NO和水,其化学方程式是4NH3+5O2 4NO+6H2O。
4NO+6H2O。
(2)①2NO(g)+O2(g)  2NO2(g),该反应是气体体积减小的可逆反应,增大压强,平衡向右移动,NO的平衡转化率升高,所以p1、p2的大小关系为p1 <p2;②升高温度,NO的平衡转化率降低,说明平衡逆向移动,而升高温度,平衡向吸热反应方向移动,则该反应的正向反应是放热反应,对于放热反应,升高温度,化学反应平衡常数减小。
2NO2(g),该反应是气体体积减小的可逆反应,增大压强,平衡向右移动,NO的平衡转化率升高,所以p1、p2的大小关系为p1 <p2;②升高温度,NO的平衡转化率降低,说明平衡逆向移动,而升高温度,平衡向吸热反应方向移动,则该反应的正向反应是放热反应,对于放热反应,升高温度,化学反应平衡常数减小。
(3)①2NO2(g) N2O4(g)ΔH1和2NO2(g)
N2O4(g)ΔH1和2NO2(g) N2O4(l)ΔH2都是放热反应,反应物的能量高于生成物的能量,C图错误;同一物质气态时的能量高于液体时的能量,A图正确;B图错误;选A。
N2O4(l)ΔH2都是放热反应,反应物的能量高于生成物的能量,C图错误;同一物质气态时的能量高于液体时的能量,A图正确;B图错误;选A。
②N2O4与O2、H2O反应生成硝酸,化合的化学方程式是2N2O4+O2+2H2O===4HNO3。
(3)根据电解示意图可知,电解NO制备硝酸铵,阳极反应为:NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出若要使电子得失守恒,阳极产生的NO3-的量大于阴极产生的NH4+的量,总反应为8NO+7H2O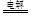 3NH4NO3+2HNO3,应补充适量的氨气,则理由为根据反应8NO+7H2O
3NH4NO3+2HNO3,应补充适量的氨气,则理由为根据反应8NO+7H2O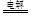 3NH4NO3+2HNO3,电解产生的HNO3多。
3NH4NO3+2HNO3,电解产生的HNO3多。
考点:考查化学反应的书写,影响化学平衡的因素,化学图像的分析及电解的应用。
本题难度:困难