微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室制取气体时,吸收尾气的方案,正确的是:
①向KMnO4晶体中加入浓盐酸,产生的气体进行漂白实验后的尾气用NaOH溶液吸收;②向Na2SO3晶体中滴入浓H2SO4,尾气用氨水吸收;③向FeS固体中滴入稀盐酸,最后的尾气用CuSO4溶液吸收;④浓H2SO4与食盐晶体共热,将多余的气体用水吸收;
A.①④
B.②③
C.①③④
D.①②③④
参考答案:D
本题解析:①会产生氯气,用碱液吸收,正确。②会产生SO2,能溶于氨水中,正确。③中产生硫化氢气体,和硫酸铜反应生成氯化铜沉淀,正确。④中产生氯化氢,氯化氢极易溶于水,正确。答案选D。
本题难度:简单
2、实验题 (8分)在实验室制各氯气的实验中:制法
(1)反应原理(方程式)为
(2)实验装置如图所示
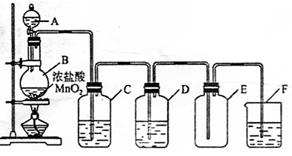
指出下列装置中所盛试剂及其作用:
C.??????????????????????????????????????????????????????
D.??????????????????????????????????????????????????????
F.??????????????????????????????????????????????????????
参考答案:
 本题解析:略
本题解析:略
本题难度:简单
3、选择题 下列气体不能用排水法收集的是 [???? ]
A.NO??????????????????
B.CO???????????????????
C.Cl2???????????????????????????
D.NO2
参考答案:CD
本题解析:
本题难度:简单
4、实验题 (2014届山东省泰安市高三第一轮复习质量检测化学试卷)
碘化钠是制备无机和有机碘化物的原料,在医药上用作祛痰剂和利尿剂等。工业上用铁屑还原法制备NaI,其主要流程如下图:
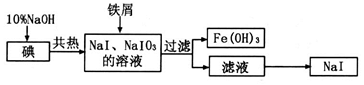
(1)写出铁屑转化为Fe(OH)3反应的离子方程式:????????????????????????????????。
(2)判断碘已完全反应的方法是????????????????????????????????????。
(3)由滤液得到NaI晶体的操作是????????????????????????????????????。
(4)测定产品中NaI含量的方法是:
a.称取3.000g样品溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.100mol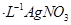 溶液滴定至终点,消耗
溶液滴定至终点,消耗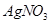 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有?????????????????????????,
其中使用前需进行润洗的仪器是????????????????????????;
②上述样品中NaI的质量分数为??????????????????????????????????????????????。
参考答案:(1)2Fe+IO3?+3H2O=2Fe(OH)3↓+I?(
本题解析:
(1)根据流程图可以看出,NaOH与I2共热反应可生成NaI和NaIO3,加入铁屑生成了Fe(OH)3和NaI,所以铁屑转化为Fe(OH)3反应的离子方程式为:2Fe+IO3?+3H2O=2Fe(OH)3↓+I?
(2)利用I2能使淀粉变蓝的现象判断碘是否反应完全:用小试管取溶液少许,向其中滴加几滴淀粉溶液,如果溶液不变蓝色,则证明碘反应完全。
(3)NaI溶液在蒸发水时,没有副反应发生,所以采用蒸发、结晶的方法得到NaI晶体。
(4)①250mL容量瓶、滴定管需要检查是否漏液,滴定管在使用前需要进行润洗。
②根据AgNO3的物质的量求算NaI的物质的量,所以样品中NaI的质量分数为:0.100mol/L×0.019L×150g/mol×10÷3.000g×100%=95%
本题难度:一般
5、选择题 下列说法正确的是????????????????????????????????????????????????????????????????????????????????????????(???)
A.将25g CuSO4·5H2O溶于1L水中,可配制成0.1 mol·L-1CuSO4溶液
B.用盐析法除去氢氧化铁胶体中混有的氯离子
C.用向下排空气法收集NH。,并用湿润的蓝色石蕊试纸检验NH。是否收集满了
D.制乙炔时,用饱和食盐水代替水是为了减缓电石与水的反应速率
参考答案:D
本题解析:选项A应将25g CuSO4·5H2O溶于水中,最后配成1L溶液。选项B应该用渗析法。选项C应该用湿润的红色石蕊试纸检验NH。是否收集满了。
本题难度:简单