微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为????????;化合物A与H2O反应的离子方程式为???????????????????。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是??????????????????????????。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 ?????????????????????????。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是??????
A.亚硫酸钠
B.KOH
C.醋酸
D.Fe(NO3)3
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案?????。
参考答案:(1)K2FeO4;4FeO42-+10H2O=4Fe(OH
本题解析:
试题分析:n(Fe)=" 2×1.60g÷160g/mol=0.02mol;m(Fe)=" n(Fe)×M=0.02mol×56g=1.12g;n(K2SO4)=" 10.44g" ÷174g/mol=0.06mol。所以原固体中含有K+的物质的量为:0.06mol×2-0.08mol=0.04mol;其质量是m(K+)=0.04mol÷39g/mol=1.56g;所以化合物A中含有O的物质的量为(3.96g-1.12g-1.56g)÷ 16g/mol =0.08mol.所以n(K+): n(Fe):n(O)=" 0.04mol:" 0.02mol: 0.08mol=2:1:4,因此该化合物的化学式为K2FeO4;根据题意化合物A与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;(2)化合物A还可作为一种“绿色高效多功能”水处理剂,是因为在K2FeO4中Fe的化合价为+6价,具有强氧化性可以杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体净水;(3)在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式是3KClO+4KOH+2Fe(OH)3=2K2FeO4+3KCl+5H2O ;(4)A.亚硫酸钠有还原性,溶液与K2FeO4发生反应,不能提高它的稳定性。错误。B.根据A在水溶液中的反应可知KOH可抑制其反应,因此可通过特点稳定性。正确。C.醋酸会消耗其水解产生Fe(OH)3和OH-,是其不断反应而消耗,不利于其的稳定存在。错误。D.Fe(NO3)3电离产生的Fe3+与A水解产生的OH-结合转化为Fe(OH)3;使其不断消耗。错误。(5)为研究温度对化合物A水溶液稳定性的影响,可以设计实验方案取少量的样品放入试管加水溶解,分成两等份于两试管中,一个放入热水中,一个放在冷水中,观察生成红褐色沉淀的快慢。从而得到结论。
本题难度:一般
2、实验题 水蒸气通过灼热的煤所产生的混合气,其主要成份是CO、H2,还含有CO2和水蒸气请用下列装置设计一个实验,如图以确认上述混合气中含有CO和H2。

(1)连接上述装置的正确顺序是:(填各接口的代码字母)
混合气→(???)(???)接(???)(???)接(???)(???)接(???)(???)接(???)(???)。
(2)确认混合气中有H2的实验现象是______;
其理由是_______________。
参考答案:(1)混合气→(E)(F)接(D)(C)接(A)(B)接(J
本题解析:完全仪器连接的关键有三点;①在H2和CO还原CuO之前,应将混合气中的CO2和水蒸气除去,以防对后面实验的干扰,应先吸收CO2(可用NaOH溶液),而后再吸收水分(防止吸收CO2所用的NaOH溶液中有水蒸气带出,不能完全除去水);②吸收CO2最好用NaOH溶液,吸收完全,确认CO2的生成最好用石灰水(得到浑浊物便于观察);③H2、CO还原CuO后确认氧化产物H2O和CO2时,首先确定水蒸气,而后确定CO2。
本题难度:一般
3、选择题 下列实验能达到相应目的的是
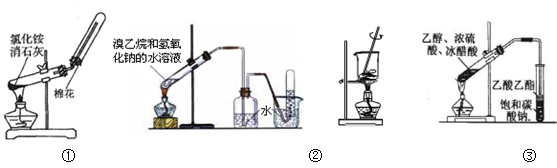
A.用图①装置制取并收集氨气
B.用图②装置制取和收集乙烯
C.用图③装置将海带灼烧成灰
D.用图④装置制取乙酸乙酯
参考答案:D
本题解析:
试题分析:A、实验室制取氨气时,因为有水生成,所以发生装置的试管应向下倾斜,错误;B、溴乙烷与氢氧化钠的水溶液发生取代反应,得到的是乙醇,不是乙烯,错误;C、灼烧海带应在坩埚中进行,错误;D、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,所以用饱和碳酸钠吸收,正确,答案选D。
本题难度:一般
4、选择题 可用碱石灰干燥的气体是( )
A.NH3
B.Cl2
C.HCl
D.CO2
参考答案:碱石灰是氧化钙和氢氧化钠的混合物,所以碱石灰是碱性物质,不能
本题解析:
本题难度:简单
5、选择题 用下图实验装置(可添加加热或尾气处理装置)进行以下实验,无法达到目的的是
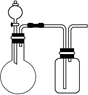
A.实验室制取并收集少量NO2
B.实验室制取并收集少量NH3
C.验证非金属性:C>Si
D.验证氧化性:Cl2>I2
参考答案:B
本题解析:
试题分析:A、用Cu和浓硝酸反应制取NO2,向上排空气收集可得NO2,正确;B、NH3的密度小于空气,集气瓶中进气的导管要短,排出气体的导管应该长,错误;C、用CaCO3与稀盐酸反应制取CO2,然后把CO2通入Na2SiO3溶液,可验证C、Si元素的非金属,正确;D、用KMnO4和浓盐酸制取Cl2,然后把Cl2通入KI溶液,可验证Cl2和I2的氧化性,正确。
本题难度:一般