微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏伽德罗常数的值,下列说法中正确的是(??????)
A.84gNaHCO3晶体中含有NA个CO32-
B.9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA
C.标准状况下,11.2L臭氧中含NA个氧原子
D.78gNa2O2与足量的CO2反应,电子转移个数为2NA
参考答案:B
本题解析:
试题分析:A、NaHCO3晶体中不存在CO32-,错误;B、NO2和N2O4的最简式相同都为NO2,所以9.2g的混合气体中含NO2为0.2mol,氮原子数为0.2NA,正确;C、标准状况下,11.2L臭氧的物质的量为0.5mol,所以氧原子数为1.5NA,错误;D、Na2O2与足量的CO2反应中,Na2O2既作氧化剂又作还原剂,所以78gNa2O2与足量的CO2反应,电子转移个数为NA,错误,答案选B。
本题难度:一般
2、选择题 下列说法正确的是()
A.1 mol CO和1 mol N2所含分子数相等,质量相等,它们所占的体积也相等
B.22.4 L H2和71 g Cl2恰好反应生成2 mol HCl
C.非标准状况下,1 mol任何气体的体积有可能是22.4 L
D.1 mol HCl和1 mol H2O在标准状况下的体积都约是22.4 L
参考答案:C
本题解析:若不是在相同温度和压强下,1 mol CO和1 mol N2所占的体积不相等,A错误;非标准状况下,22.4 L H2的物质的量无法确定,B错误;标准状况下,水不是气态,1 mol H2O的体积不是22.4 L,D错误。正确答案为C。
本题难度:简单
3、选择题 现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为( )
A.1.0g
B.2.0g
C.2.5g
D.3.5g
参考答案:C
本题解析:
试题分析:锌粉与浓硫酸反应生成二氧化硫与氢气的混合气体,共11.2L(0.5mol)。不论生成二氧化硫还是氢气都是得到两个电子,即SO42-___ SO2得两个电子,氢气也是一样,所以生成的混合气体为0.5mol,那么得到的电子为1mol。根据电子得失守恒,可以计算出锌为0.5mol,即32.5克,过剩的锌粉质量为2.5g。
考点:化学反应的计算
点评:本题难度不大,只要分析清楚锌粉与浓硫酸的反应就可以了。还需要学生合理利用电子守恒的原理。这是解题的技巧。
本题难度:一般
4、选择题 在0℃和101 kPa的条件下,将4.00 g氩气、1.40 g氮气和1.60 g氧气混合,该混合气体的密度是相同条件下氢气密度的(??? )
A.35倍
B.17.5倍
C.7倍
D.14倍
参考答案:B
本题解析:三种气体的物质的量分别是0.1mol、0.05mol和0.05mol,则混合气的平均相对分子质量是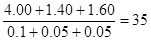 。由于在等温等压时,气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气密度的35÷17.5倍,答案选B。
。由于在等温等压时,气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气密度的35÷17.5倍,答案选B。
本题难度:一般
5、选择题 把a L硫酸铵和硝酸铵的混合液分为两等份,一份需用b mol 烧碱刚好把氨全部赶出,另一份与BaCl2溶液反应恰好消耗c mol BaCl2。则原溶液中NO的物质的量浓度是( )
参考答案:D
本题解析:在每份混合液中,c(NH4+)=b mol·L-1,c(SO42-)=c mol·L-1,由电荷守恒可得c(NO3—)=b—2c mol·L-1,而溶液体积为a/2 升,所以原溶液中NO3—的物质的量浓度是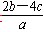 mol·L-1
mol·L-1
本题难度:一般