微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是( ? )
A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30?min内用N2O4表示的平均化学反应速率是0.04?mol?L-1?min-1
D.反应进行至25?min时,曲线发生变化的原因是增加N2O4浓度
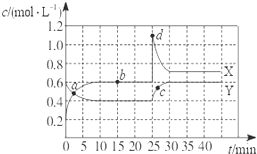
参考答案:D
本题解析:
本题难度:简单
2、填空题 (5分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
(2)若升高温度,则该反应的平衡常数 (填“增大”、“减小”或“不变”).
(3)判断该条件下反应 (填能、不能)自发.
参考答案:(1)B(1分) (2)减小(2分)(3)能(2分)
本题解析:略
本题难度:一般
3、选择题 某温度下,在体积为2L的密闭容器中,充人1mol?A和a?mol?B气体,发生如下反应:A(g)+B(g)?2C(g).5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系曲线如图所示.下列叙述正确的是( )
A.0~5?min,C物质的平均反应速率为0.04?mol/(L?min)
B.图中T1时的正反应速率等于T2时的正反应速率
C.T2时的平衡常数大于T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
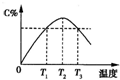
参考答案:C
本题解析:
本题难度:一般
4、选择题 反应SO2(g)+NO2(g) NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 [???? ]
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 [???? ]
A.平衡左移,容器内压强不一定增大
B.平衡右移,达到平衡时容器压强不一定增大
C.平衡不一定发生移动,容器内压强一定增大
D.平衡右移,SO2的转化率提高
参考答案:BD
本题解析:
本题难度:一般
5、填空题 党的十八大报告中首次提出“美丽中国”的宏伟目标。节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:

请回答下列问题:
(1)装置甲为电解池,根据图示转化关系可知:A为____________(填化学式),阴极反应式为____________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是_________________________________________________
装置戊进行反应时需要的环境为________(填字母序号)。
A.HCl气体氛围中? B.空气氛围中??? C.氩气氛围中? D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)??CH3OH(g) ΔH<0。
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃
| 250
| 350
|
K
| 2.041
| x
?
符合表中的平衡常数x的数值是________(填字母序号)。
A.0? B.0.012? C.32.081? D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
?
| c(CO)
| c(H2)
| c(CH3OH)
| 0 min
| 0.8 mol·L-1
| 1.6 mol·L-1
| 0
| 2 min
| 0.6 mol·L-1
| y
| 0.2 mol·L-1
| 4 min
| 0.3 mol·L-1
| 0.6 mol·L-1
| 0.5 mol·L-1
| 6 min
| 0.3 mol·L-1
| 0.6 mol·L-1
| 0.5 mol·L-1
?
反应从2 min到4 min之间,H2的平均反应速率为________。反应达到平衡时CO的转化率为________。反应在第2 min时改变了反应条件,改变的条件可能是________(填字母序号)。
A.使用催化剂? B.降低温度
C.增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为____________ ________________________________________________。
参考答案:(1)Cl2 2H2O+2e-=H2↑+2OH-
(2
本题解析:(1)装置甲为电解饱和NaCl溶液的装置,阳极为Cl-失电子,被氧化为Cl2,阴极水电离的H+得电子,生成氢气和NaOH。
(2)装置丙和装置戊的作用是提纯Ti。装置戊中发生的反应是钠还原TiCl4的反应,而高温条件下钠与氧气反应,需要无氧和无水环境。
(3)①ΔH<0,所以正反应为放热反应,故平衡常数随着温度的升高而降低,x<2.041,而且因为是可逆反应,平衡常数不可能为0。②根据表格中CO或CH3OH的浓度可知y=1.2 mol·L-1,所以反应从2 min到4 min之间,
本题难度:困难
|
|
网站客服QQ: 960335752 - 14613519 - 791315772