微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 大气固氮和合成氮是周氮的重要形式。下表是大气固氮和合成氨的部分K值:
?
| N2+O2 2NO 2NO
| N2+3H2 2NH3 2NH3
|
温度
| 25℃
| 2000℃
| 25℃
| 400℃
|
平衡常数K
| 3.84×10-31
| 0.1
| 5×108
| 200
?
(1)大气固氮是_______(“吸热”、“放热”)反应;人工固氮对农业意义十分重大,根据表中数据,可推知合成氨最重要的研究方向是______________________________________。
(2)工业合成氨原料气的制备主要方法如下:
①以空气为原料制备N2,其方法是______________________________________。
②以焦炭和水为原料制备H2,反应原理为____________________、__________________。
H2中混有的CO可用醋酸亚铜氨溶液吸收,以防止合成氨时催化剂中毒:
CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC·CO(aq)+Q(Q>0) Cu(NH3)2AC·CO(aq)+Q(Q>0)
要从除杂后的溶液中“再生”出醋酸亚铜氨,可________(“升”“降”)温、____(“增”“降”)压。
(3)液氨和水类似,也能自离解(电离):NH3+NH3 NH4++NH2-。 NH4++NH2-。
①液氨的离子积可以表示为________________。
②25℃时,液氨的离子积K=1.0×10-30。若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)_________ (选填编号)
a.c(Na+)=c(NH2-)??? b.c(NH4+)·c(NH2-)=1.0×10-30?????c.c(NH2-)> c(NH4+)
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为_______________________。
参考答案:(1)吸热(1分);寻找常温下能发生反应的催化剂(1分)。<
本题解析:
试题分析:(1)根据表中数据,温度升高,平衡常数增加,说明大气固氮是吸热反应;人工固氮对农业意义十分重大,根据表中数据,可推知合成氨最重要的研究方向是寻找常温下能发生反应的催化剂。
(2)①以空气为原料制备N2,其方法是将空气加压使其液化,然后蒸发(蒸馏),分离出氮气和氧气。(或将碳在空气中燃烧,除去CO2)。②以焦炭和水为原料制备H2,反应原理为C(s)+ H2O (g)=CO+ H2(1铃);CO+ H2O (g)=CO2+ H2O。CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC·CO(aq)+Q(Q>0)正反应是放热反应, 要从除杂后的溶液中“再生”出醋酸亚铜氨,可升温降压,可使平衡左移即可。 Cu(NH3)2AC·CO(aq)+Q(Q>0)正反应是放热反应, 要从除杂后的溶液中“再生”出醋酸亚铜氨,可升温降压,可使平衡左移即可。
(3)NH3+NH3 NH4++NH2-。①液氨的离子积可以表示为K= c(NH4+)?c(NH2-)。②由于液氨能电离出NH2-,当加入NaNH2时电离出NH2-的量和钠离子的量肯定相等,但加上原NH2-时,就有c(Na+)<(NH2-) ,a错误; NH4++NH2-。①液氨的离子积可以表示为K= c(NH4+)?c(NH2-)。②由于液氨能电离出NH2-,当加入NaNH2时电离出NH2-的量和钠离子的量肯定相等,但加上原NH2-时,就有c(Na+)<(NH2-) ,a错误;
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为NH4++ NH2-→2NH3。
本题难度:一般
2、填空题 (8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表: CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃
| 700
| 800
| 830
| 1 000
| 1 200
| K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是________.
a.容器中压强不变????? b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO平衡浓度为0.25 mol/L,试判断此时的温度为________℃.
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________.
a.等于1.0 mol b.大于1.0 mol
c.大于0.5 mol???????????d.无法确定
参考答案:(8分)(1)?吸热??反应.(2)bc.(3)830℃.(
本题解析:(1)根据表中数据可知,随着温度的升高,平衡常数逐渐增大,说明升高温度平衡向正反应方向进行,所以正反应是吸热反应。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以b正确;根据反应的方程式可知,反应前后体积不变,所以压强也是不变的,因此选项a不正确;c中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此d不正确,答案选bc。
(3)CO平衡浓度为0.25 mol/L,所以根据方程式可知,消耗CO2和氢气的浓度都是0.25mol,则剩余CO2和氢气的浓度都是(0.5mol/L-0.25mol/L)=0.25mol,因此此时平衡常数是1,所以温度是830℃。
(4)平衡时,H2的物质的量为x,则消耗CO2和氢气的物质的量都是x,剩余CO2和氢气的物质的量分别是(2-x)和(3-x),因此有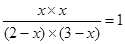 ,解得x=1.2mol,答案选b。 ,解得x=1.2mol,答案选b。
本题难度:一般
3、选择题 对于反应2SO2+O2 2SO3,下列判断正确的是 2SO3,下列判断正确的是
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时SO2消耗速度必定等于O2生成的速度
D.平衡时SO2浓度必定等于O2浓度的两倍
参考答案:B
本题解析:
试题分析:A项不能生成2体积的SO3,因为是可逆反应;B项正确;C项平衡时正逆速率相等,必须是同一种物质,不是同一种物质,速率之比等于系数之比,C项错误;D项浓度应该是不变,错误。
点评:属于基础题。
本题难度:一般
4、选择题 下列有关说法正确的是
A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大
D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
参考答案:B
本题解析:A项,该反应是气体体积增大的反应,即熵增大,而反应不自发,则反应为吸热反应,即?H>0,错;B项,铁铜构成原电池,铁作负极,加快了铁的腐蚀,正确;C项,该反应为放热反应,升高温度,平衡逆向移动,H2的转化率减小,错;D项,Kw=c(H+)c(OH-),升高温度,Kw增大,即c(H+)、c(OH-)增大,说明升温促进了水的电离,故可说明水的电离为吸热反应,错。
【考点定位】化学反应原理的分析
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
本题难度:一般
5、填空题 (1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答: CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率??????????(填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是???????????(填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
浓度???????物质
| CO
| H2O
| CO2
| H2
| 起始浓度/(mol·L-1)
| 2.0
| x
| 0
| 0
| 平衡浓度/(mol·L-1)
| 0.4
| 6.4
| 1.6
| 1.6
?
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为????????????????????????????。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
参考答案:(1)①增大?②吸热?③8.0?? 1
(2)①4OH
本题解析:
试题分析:本题考查化学反应的限度、化学平衡及电解原理的应用。(1)①恒容增大H2O (g)的物质的量,H2O (g)的浓度增大,平衡正向移动,则CO的转化率增大;②若升高温度能使化学平衡向正反应方向移动,结合温度对化学平衡的影响规律:升温平衡向吸热方向移动,则正反应是吸热反应;③分析表中数据可知,CO的浓度变化为1.6 mol·L-1,结合反应方程式知,H2O的浓度变化也为1.6 mol·L-1,H2O的起始浓度为8.0 mol·L-1,x=8.0;将表中各物质的平衡浓度代入该反应的平衡常数表达式K=c(H2)c(CO2)/c(CO)c(H2O)计算得K=1;(2)电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾,①根据题给装置图分析,左侧电极与外加电源的正极相连,作电解池的阳极,电极反应式为4OH--4e-=O2+2H2O;②右侧电极与外加电源的负极相连,作电解池的阴极,电极反应式为2H+ + 2e- = H2↑,该极区产生氢氧根,制得的氢氧化钾溶液从出口D导出;③通电开始后,阴极附近溶液pH会增大,原因是阴极氢离子放电,促进水的电离,氢氧根离子浓度增大
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772