微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
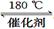
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:
NO NO2
NO2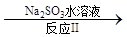 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
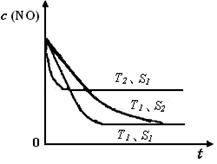
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
参考答案:(1)CH4 (g)+2NO2(g)=N2(g)+CO2(g
本题解析:
试题分析:(1)将已知的两个热化学方程式相加除以2即得,答案为CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol
(2)提高氮氧化物的转化率即使反应正向进行,根据勒夏特列原理,可采取增大NH 3的浓度或减小反应体系的压强或降低反应体系的温度等措施;
(3)反应Ⅱ中反应物为NO2、Na2SO3,产物之一有N2,根据氧化还原反应理论,可推断另一产物为Na2SO4化学方程式是2NO2 + 4 Na2SO3 = N2 + 4 Na2SO4;若生成11.2 L N2(标准状况),其物质的量为0.5mol,消耗NO2的物质的量为1mol,从而可计算出消耗ClO2的质量为67.5g;
(4)根据化学平衡中的“先拐先平”规律,温度高的先达平衡,表面积大的速率快,先达平衡,所以T2>T1,S1>S2,随温度升高,CO的浓度增大,说明升温平衡逆向移动,正向是放热反应△H<0。
考点:考查盖斯定律的应用、平衡移动与外界条件的关系、化学方程式的推断及计算、化学平衡图像的分析能力
本题难度:困难
2、填空题 Ⅰ、向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol·L -1HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
Ⅱ、一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
请回答下列问题:
(4)判断该反应达到化学平衡状态的标志是 (填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2
B.容器内气体的压强不变
C.容器内混合气体的密度保持不变
D.SO3的物质的量不再变化
E.SO2的生成速率和SO3的生成速率相等
(5) SO2的转化率 。
参考答案:(1)3Cu2O+ 14H+ + 2NO3-=6Cu2+ +
本题解析:
试题分析:(1)硝酸有强氧化性,Cu2O有还原性,二者会发生氧化还原反应,Cu2O跟稀硝酸反应的离子方程式是3Cu2O+ 14H+ + 2NO3-=6Cu2+ +2 NO↑+ 7H2O;(2)根据N元素守恒可知n(N)=2n(Cu)+n(NO).所以n(Cu)= [n(N)-n(NO)]÷2="[1" L× 0.6 mol/L-0.1mol]÷2=0.25mol,因此若将上述混合物用足量的H2加热还原,所得到固体Cu的物质的量是0.25mol,其质量为0.25mol×64g/mol=16g;(3)若混合物中含0.1 mol Cu,由于混合物中含有Cu元素的物质的量为0.25mol,假设含有CuO的物质的量为x,则含有Cu2O的物质的量为(0.25-0.1-x)/2mol,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为根据电子转移守恒,混合物中n(Cu2O)=(0.1×3-0.1×2)mol÷2=0.05mol;再结合(2)中Cu元素物质的量计算混合物中n(CuO)=(0.25-0.1-0.05×2)mol=0.05mol,根据Cu不与稀H2SO4反应,Cu2O、CuO与稀H2SO4反应,Cu2O、CuO与硫酸发生反应时物质的量的比为1:1可知 0.05molCu2O、0.05molCuO共消耗硫酸的物质的量为n(H2SO4)=0.05mol+0.05mol=0.1mol。(4) A.物质反应时是按照2∶1∶2关系进行的,但是反应达到平衡时的物质的量浓度关系可能是该比例,也可能不是,因此不能作为判断平衡的标志,错误;B.由于该反应是反应前后气体体积不等的反应,所以若反应未达到平衡,则容器内的压强就会发生变化,所以容器内气体的压强不变可以作为反应达到平衡的标志,正确;C.化学反应遵循质量守恒定律,所以在任何时刻反应容器内混合气体的密度都保持不变,故不能作为判断平衡的标志,错误;D.若SO3的物质的量不再变化,则物质的浓度就不变,反应达到平衡,正确;E.由于每产生1个SO2就会同时消耗1个SO3,若SO2的生成速率和SO3的生成速率相等,则SO2和SO3的浓度保持不变,反应达到平衡,因此可以作为判断化学反应平衡的标志,正确。(5) 在恒容的密闭容器内气体压强是原来的0.7倍,则气体的物质的量的开始时的0.7倍。假设反应消耗O2的物质的量为x,则消耗SO2的物质的量为2x;达到平衡时各种气体的物质的量为SO2: (0.4 -2x)mol ;O2:(0.2 -x)mol;SO3: 2xmol;根据题意可得{(0.4 -2x)+(0.2 -x)+ 2x )÷(0.4+0.2)=0.7,解得x=0.18mol,所以发生反应的SO3的物质的量为0.36mol,故SO2的转化率(0.36mol÷0.4mol)×100%=90%。
考点:考查氧化还原反应的离子方程式的书写、守恒法在化学计算中的应用、可逆反应平衡状态的判断、物质转化率的计算的知识。
本题难度:一般
3、选择题 自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单晶硅等。试想,如果把某元素由化合态变为游离态,则该元素
A.被氧化
B.有可能被氧化,也有可能被还原
C.被还原
D.该元素既不被氧化也不被还原
参考答案:B
本题解析:元素由化合态变为游离态,可能是失去电子,比如:Cl2+2KBr=2KCl+Br2
也可能是得到电子,比如:Fe+CuCl2=FeCl2+Cu。所以有可能是被氧化,也有可能被还原。答案选B。
本题难度:简单
4、选择题 用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是
A.+4
B.+3
C.+2
D.+1
参考答案:A
本题解析:
试题分析:设元素X在还原产物中的化合价是n价,根据氧化还原反应中得失的电子守恒可知,0.03L×0.1mol/L×(6-4)=2×10-3mol×(7-n),解得n=+4。
考点:考查氧化还原反应中化合价的有关计算。
本题难度:困难
5、填空题 (5分)(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是 。
(2)浓盐酸在反应KClO3+HCl
参考答案:
本题解析:
本题难度:一般