微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题
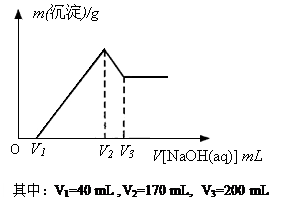
(1)请写出加入NaOH溶液的体积由V2→V3时,所发生的化学反应方程式:___________________?? _??_______,并由此计算合金中铝的质量。
(2)计算合金中镁的质量。
(3)合金在溶于稀硫酸时,释放出的气体体积(标准状况)是多少?
(4)康康同学所用稀硫酸的物质的量浓度是多少?
参考答案:(1) Al(OH)3 + NaOH? ="=" Na[Al
本题解析:(1)Al(OH)3 + NaOH? ="=" Na[Al(OH)4](2分),0.15 mol(1分)。
(2)2.4 g(过程1分,结果1分,共2分)
方法1:由Al的物质的量计算:在V1→V2时,Al3+消耗NaOH溶液的体积;进而得出Mg2+消耗NaOH溶液的体积,从而计算Mg的质量。
方法2:Al3+沉淀再溶解时消耗NaOH溶液的体积关系(3∶1),可直接得到Mg2+消耗NaOH溶液的体积为: (V2-V1)-3(V3-V2),从而计算Mg的质量。
(3)7.28 L(过
本题难度:简单
2、填空题 铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系:
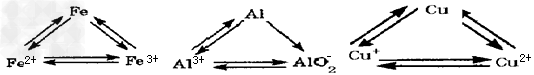
请回答下列问题
(1)氮化铝是一种性能良好的高温结构陶瓷,它的电子式:_________; 铁在周期表中的位置:_____________;?
(2)铜生成铜绿是生活中常见的现象,其反应原理用方程式表示:_________;??氢氧化铝被称为两性氢氧化物,写出其酸式电离方程式:__________________;
(3)高铁酸盐被科学家们公认为绿色消毒剂,?它可以通过如下途径制备:次氯酸盐氧化法制备:采用次氯酸盐氧化法,在10.00?mL质量分数为8%的次氯酸钠溶液中加入5.5?g氢氧化钠和0.70?g硫酸铁,可制备摩尔浓度(物质的量浓度)为0.01?mol/L的高铁酸钠,写出制备的离子方程式:??__________________高铁酸钠不仅可以消毒,也可以作净水剂,陈述理由:__________________
(4)燃料电池如图所示,写出石墨(I)电极上发生的电极反式:__________________?。以此燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4?溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1?mol?Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为_____________.。

(5)某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液实验记录:

背景资料:

某同学对实验中的白色沉淀进行分析,利用资料卡片资料①②大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案。

参考答案:(1)![]() 本题解析:
本题解析:
本题难度:一般
3、选择题 下列叙述不正确的是( )
A.铝是地壳中含量最多的金属元素
B.铝在空气中能稳定存在,是因为表面覆盖着保护膜
C.实验室制备Al(OH)3,常用铝盐溶液与NaOH反应
D.Al(OH)3是一种医用胃酸中和剂
参考答案:A、根据地壳中元素的含量分析,铝是地壳中含量最多的金属元素,
本题解析:
本题难度:简单
4、选择题 将表面已完全氧化的铝条,插入下列溶液中,不会发生反应的是(??? )
A.稀硝酸
B.稀盐酸
C.硝酸铜
D.氢氧化钠
参考答案:C
本题解析:A可以反应,稀硝酸为强氧化性酸,能与大多数金属反应;B可以反应,稀盐酸能与氧化铝反应,反应后能与AL进一步反应;C不可以;D可以反应,氧化铝为典型的两性氧化物能与强碱反应,且铝也能与强碱反应;
本题难度:一般
5、选择题 将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
A.硫酸
B.硝酸钠
C.硫酸锌
D.氯化铜
参考答案:B
本题解析:分析:将铁屑溶于过量的盐酸中,所以说氢离子过量,铁反应完全后,氢离子还有剩余.
A.硫酸不能氧化二价铁离子;
B.硝酸具有强氧化性,可以将二价铁离子氧化为三价铁离子;
C.硫酸锌与二价铁离子不反应;
D.氯化铜与二价铁离子不反应;
解答:盐酸不能把铁氧化到最高价态,将铁屑溶于过量的盐酸中,发生反应:Fe+2HCl=FeCl2+H2↑
A.因为盐酸硫酸不具备强氧化性,不能氧化二价铁离子,所以,没有三价铁离子生成,故A错误;
B.将铁加入过量的盐酸中,铁反应完全后氢离子还有剩余,加入硝酸锌后,硝酸锌溶解,电离出硝酸根离子,而硝酸根离子和氢离子在同一溶液相当于硝酸,而硝酸具有强氧化性,可以将二价铁氧化为三价铁离子,故B正确;?
C.硫酸锌溶解,电离出硫酸根离子,与过量的氢离子在同一溶液,相当于稀硫酸,而稀盐酸硫酸不具备强氧化性,不能氧化二价铁离子,故C错误;
D.氯化铜溶于水,电离出氯离子,与过量的氢离子在同一溶液,相当于稀盐酸,盐酸不能把二价铁离子氧化,故D错误;故选B.
点评:该题主要考查了硝酸的氧化性,解题时须注意,题干和选项不一定明显显示加硝酸,通过先后加入的物质形成硝酸溶液.
本题难度:简单