微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为?????????????????????????????????????????。
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
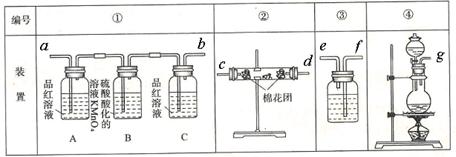
实验时可观察到装置①中A瓶中的溶液退色,C瓶中的溶液不退色。A瓶中的溶液的作用是
????????????????????????;B瓶中的溶液的作用是????????????????????????;C瓶中的溶液的作用是??????????????????。
(3)装置②中所加固体药品是无水硫酸铜。可验证的产物是???????????????。
(4)装置③中所盛溶液是澄清石灰水,可验证的产物是??????????????????。
参考答案:(10分 )(1)2H2SO4(浓) + C![]()
本题解析:略
本题难度:一般
2、实验题 (8分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当,也消耗1 mol OH-],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。(1)根据步骤Ⅲ填空:
①用NaOH标准溶液滴定滴定锥形瓶中溶液时,左手控制??????式滴定管,右手摇动锥形瓶,眼睛注视______________??????????????_。直到因加入一滴NaOH溶液后,溶液由无色变为红色,并且______________??????????????????????????为止
②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
③移取25.00 mL样品的滴定管,移取前尖嘴处有气泡,移取后气泡消失,则滴定时用去NaOH标准溶液的体积???? (填“偏大”、“偏小”或“无影响”)
(填“偏大”、“偏小”或“无影响”)
(2)滴定结果如下表所示:
滴定次数
| 待测溶液的体积/mL
| 标准溶液的体积/mL
|
滴定前刻度
| 滴定后刻度
|
第一次
| 25.00
| 1.02
| 20.99
|
第二次
| 25.00
| 2.00
| 22.03
|
第三次
| 25.00
| 0.00
| 22.00
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
参考答案: 本题解析:略 本题解析:略
本题难度:一般
3、实验题 (10分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示):????????????????????。
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是?????????????????????????????????????????。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

(3)B装置中试剂的化学式是????????,C装置中试剂的名称是?????????????。
(4)能证明乙同学观点正确的预期实验现象是????????????????????????????????。
(5)若丙同学的观点正确,用上述装置通过B、C中质量的增加来定量测定沉淀的组成,该装置存在的主要缺点是???????????????????????????????(任答1条即可)。
参考答案:(1) Cu2++ CO32-+H2O= Cu(OH)2 ↓
本题解析:
试题分析:(1)乙同学的观点,是考虑到了CO32-的水解,所以离子方程式为
Cu2++ CO32-+H2O= Cu(OH)2 ↓+CO2↑
(2)洗涤干净的标准是没有含有SO42-,故可以加入钡盐来检验,规范做法是取最后一次洗涤液(或上层清液),滴加BaCl2(或硝酸钡)溶液,无沉淀生成,说明已洗净。
(3)该装置一是为了检验是否有水生成,另一是检验是否有CO2。若有水生成,说明是Cu(OH)2,若有CO2生成,说明是CuCO3。故B装置是一个干燥装置,来检验是否有水生成,为了使现象明显,故可以采用无水硫酸铜,化学式为CuSO4,C装置是为了检验是否有二氧化碳生成,故是澄清石灰水。
(4)乙同学的观点是生成Cu(OH)2,故沉淀加热后会生成水,故B装置变蓝,C装置没明显变化
(5)该装置没有排除装置原有的空气,也没有一个收集多余气体的装置,也没消除空气对澄清石灰水的影响
点评:此题考核了实验探究的步骤,从猜想到验证,学生要充分理解题中所给装置的用途。
本题难度:一般
4、实验题 某实验小组在进行双氧水分解的实验时发现:大家取相同体积、不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究.
(1)用下列简图,在方框中画出实验装置(含试剂)示意图.??
(2)小组经过实验,取得如下数据:??????????????????

(说明:表中X是二氧化锰的质量;Y是指反应停止时的时间;Z是双氧水的含量) 分析表中数据回答下列问题:
①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而________.
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择,理由是_____________________.
③该小组的小茂同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_________________. (提示:可比较相同体积的3.0%与1.5%的双氧水中所含溶质的倍数大小与二者反应结束所用时间的倍数大小作出比较)
参考答案:(1)![]() 本题解析: 本题解析:
本题难度:一般
5、实验题 (15 分)
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

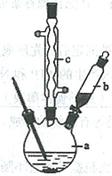
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
??????????????????????????。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是?????????????????????;仪器c的名称是??????????????,其作用是???????????????????????????????????????????。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是????????????。下列仪器中可用于分离苯乙酸粗品的是????????????????(填标号)。
A.分液漏斗
B.漏斗
C.烧杯
D.直形冷凝管E.玻璃棒
(3)提纯粗苯乙酸的方法是?????????????,最终得到44 g纯品,则苯乙酸的产率是????????。
(4)用CuCl2??? ? 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是????????????????????????????????????????????。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是???????????????????。
参考答案:
⑴先加水、再加入浓硫酸(1分)
⑵滴加苯乙腈(
本题解析:
试题分析:⑴蒸馏水与浓硫酸混合应先加水、再加入浓硫酸,防止暴沸。
⑵仪器b为分液漏斗,通过分液漏斗向三口瓶a中滴加苯乙腈;仪器c为球形冷凝管,能起到冷凝回流的作用(使气化的反应液冷凝);反应结束后加适量冷水,便于苯乙酸(微溶于冷水)结晶析出,通过过滤能从混合液中分离出苯乙酸粗品,过滤所用的仪器主要有漏斗、玻璃棒、烧杯等。
⑶将粗苯乙酸晶体重新在热水中溶解,然后再降温结晶过滤(重结晶)可得较纯净的苯乙酸晶体;根据“1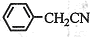 ~1 ~1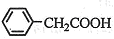 ”关系式,可计算苯乙酸的产率= ”关系式,可计算苯乙酸的产率=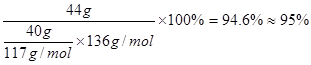 。 。
⑷在制备Cu(OH)2沉淀的同时还有可溶性NaCl生成,故判断沉淀洗干净的方法就是检验最后一次洗涤液中是否还含有Cl-。
⑸根据“苯乙酸微溶于冷水,溶于乙醇”,故乙醇与水的混合溶剂中的乙醇能增大苯乙酸的溶解度,便于充分反应。
本题难度:一般
|