微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:
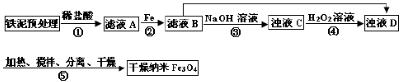
Fe
?
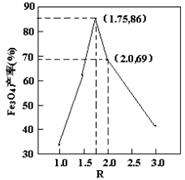
已知:R= ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
(1)步骤②中,主要反应的离子方程式是______。
(2)已知:Fe3+在pH=2.8时沉淀完全; Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是______。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是______。
(4)下列说法正确的是______(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时,n(FeOOH)/n(Fe2+)="2:1"
d.当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率最高
参考答案:(1)2Fe3++Fe=3Fe2+
(2)使亚铁离子沉
本题解析:
试题分析:(1)滤液A中含有Fe3+,加入Fe后发生反应:2Fe3++Fe=3Fe2+
(2)Fe2+在pH=8.3时沉淀完全,所以步骤③中,用NaOH溶液调pH至9,亚铁离子沉淀完全。
(3)浊液C含有Fe(OH)2,加入H2O2,发生氧化还原反应,生成FeOOH,化学方程式为:2Fe(OH)2+H2O2=2FeOOH+2H2O。
(4)a、步骤④中,当反应完成后需再加热一段时间,可除去剩余的H2O2,正确;b、步骤⑤发生的反应为:2FeOOH+Fe2++2OH?=Fe3O4+
本题难度:一般
2、实验题 FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(3)如果没有装置C的设计,会导致???????????????????????
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用:????????????。
(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ ???????? 。
为探究溶液的组成,实验如下:
实验步骤
| 实验现象
| 实验结论及反应离子方程式
| ①取少量所得溶液于试管中,加入少量KSCN溶液。
| _________________。
| 说明:假设②不成立,假设①或③成立;反应的离子方程式是_____________。
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。
| 溶液紫红色退去
| 说明:________________________。
?
综合上述实验分析,所得溶液中含有的金属阳离子有????????????????????????????。
参考答案:Ⅰ(1)2Fe+3Cl2?? 本题解析: 本题解析:
试题分析:Ⅰ(1)铁和氯气在加热的条件下生成氯化铁;
(2)氯化铁在空气中易潮解,②赶走了试管中的空气,⑤既防止了空气污染,用干燥的氢气还可以防止氯化铁潮解;
(3)D装置中水挥发到接受器,使FeCl3潮解;
(4)用碱性溶液把剩余的氯气反应完,防止空气污染;
(5)发生氧化还原反应。
Ⅱ③三价铁离子和二价铁离子都有;
三价铁离子和硫氰根离子会发生络合反应,显红色;
酸性高锰酸钾可以氧化亚铁离子,使紫红色消失;
结合两个实验,所以溶液中既有二价铁离子
本题难度:困难
3、实验题 (14分)化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是?????????(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度。
甲组方案:
试剂X从下列试剂中选择:
a.0.1mol·L-1KMnO4(H2SO4酸化)溶液b.0.5mol·L-1NaOH溶液c.新制氯水d.KI溶液
①加入的试剂X为??????(填字母序号),生成SO42-主要的离子方程式为??????????????????????????????????????????????????????????。
②甲组方案中,第iii步的“系列操作”包含的操作名称各为?????????????????????????。
乙组方案:
i.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ii.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
iii.记录数据,计算。
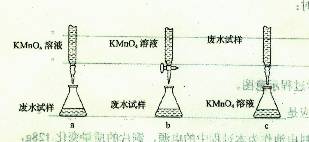
③乙组设计的下列滴定方式中,最合理的是?????????(夹持部分略去)(填字母序号)
(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊。该同学制备胶体失败的原因是???????????????????????????????????????????,你认为成功制得Fe(OH)3胶体的特征现象是?????????????????????????????????????。
(4)用下图装置进行CO2性质的有关实验。
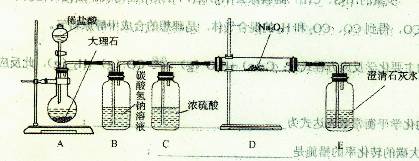
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是????????????????????????。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系???????????????????。
参考答案: 本题解析:略 本题解析:略
本题难度:困难
4、填空题 利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下:
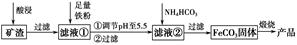
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______________________________。为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有____________________、____________________。(任举两例)
(2)调节pH至5.5的目的是______________________________________。
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是__________________________________________________。(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为_______________________________________________________。
参考答案:(1)Fe3O4+8H+=Fe2++2Fe3++4H2O 合
本题解析:由于矿渣中存在Fe2O3、Fe3O4、FeO、Al2O3、SiO2且后续步骤中加铁粉还原Fe3+,加溶液时只需要用稀盐酸或稀硫酸就可以,不需要用硝酸将铁氧化成Fe3+。
本题难度:一般
5、选择题 铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98? g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图1所示。
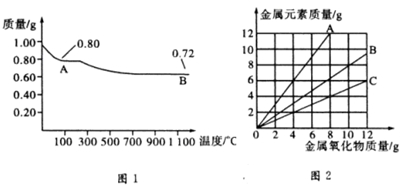
另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是
A.图1中产物A、B的化学式分别为Cu2O和CuO
B.图1整个过程中共生成0.26? g? H2O
C.图2三条曲线中,表示CuO和其中所含Cu元素质量的关系曲线是曲线A
D.图2中绘制错误的曲线共2条
参考答案:D
本题解析:
试题分析:A、由0.98? g? Cu(OH)2可知其物质的量为0.01? mol,若全部生成CuO,则质量为0.01? mol×80? g?mol-1=0.8g,所以A点是CuO;若全部生成Cu2O,则质量为0.005? mol×144? g?mol-1=0.72g,所以B点是Cu2O,故A不正确;B、根据化学方程式4Cu2O 本题难度:一般 本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772