微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是(?? )
2SO3(g)能增大正反应速率的措施是(?? )
A.通入大量O2
B.增大容器容积
C.移去部分SO2
D.降低体系温度
参考答案:A
本题解析:增大反应物O2的浓度能够增大反应速率,A对;增大容器的容积,相当于减小压强,正、逆反应速率都减小,B错;移去部分SO2,瞬间SO2浓度减小,正反应速率减小,逆反应速率不变,C错;降低体系温度,正、逆反应速率都减小,D错。
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是(?)
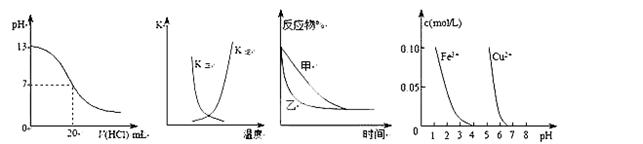
①????????????????②??????????????????③??????????????????④
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2A(g) + B(g) 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C.图③表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
参考答案:D
本题解析:
试题分析:A.当加入盐酸20mL时,pH发生骤变,题中pH变化曲线不正确,如下图,A错误
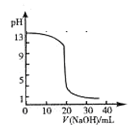
B.反应2A(g)+B(g) 本题难度:一般
本题难度:一般
3、填空题 (7分)某容积和温度不变的容器中,发生下列反应:
A(g)+2B(g) 2C(g)(正反应放热)
2C(g)(正反应放热)
回答下列问题:
(1)从A、B两气体充入容器至反应达到平衡状态,在此过程中,容器内压强____________(填“变大”“变小”或“不变”,下同),达到平衡后容器内压强___________________。
(2)使平衡体系的体积缩小,则气体A的浓度____________,气体C的物质的量___________________。
(3)化学反应达平衡状态后,加入适量的催化剂,则气体A的物质的量____________。
(4)若在平衡体系中,再充入一些气体A,则A的浓度____________,A的转化率________________________。
参考答案:(1)变小?不变?(2)变大?变大?(3)不变?(4)变大?
本题解析:(1)正反应是气体体积缩小的反应,开始到平衡的过程中,气体压强逐渐变小,达到平衡后,容器内气体的物质的量不变,气体的压强也不变。
(2)体积缩小,气体的压强变大,平衡向右移动以减弱压强的增加,但不能减弱到原来的程度,故新平衡建立时A的浓度比原平衡还是变大了;平衡向右移动,C的物质的量变大。
(3)加入催化剂,平衡不移动,A的物质的量不变。
(4)恒容下充入A,A的浓度变大,平衡向右移动,A的转化率变小,因为虽然转化的A增多了,但A的总物质的量也比原来大,且后者增率更大。
本题难度:简单
4、选择题 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是

A.该反应的△H<0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t 1min内 CH3OH的平均生成速率为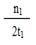 mol·L-1 min-1
mol·L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平衡时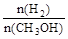 减小
减小
参考答案:AC
本题解析:
试题分析:A、由图象可知,温度越高,平衡时甲醇的物质的量越小,故升高温度平衡向逆反应方向移动,该反应正反应是放热反应,即△H<0,正确;B、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小,错误;C、根据反应速率的计算公式及题给数据计算,300℃时,0-t 1min内 CH3OH的平均生成速率为 本题难度:一般
本题难度:一般
5、填空题 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(S)+4CO(g)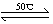 ?Ni(CO)4(g)+Q
?Ni(CO)4(g)+Q
(2)Ni(CO)4(g)  Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 ????????、???????。
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为???????。

(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时????????。
a.平衡常数K增大?? b.CO的浓度减小
c.Ni的质量减小????d.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
参考答案:
(1)及时移走Ni(CO)4,加压。
(2)0
本题解析:
(1)反应(1)是正向气体体积缩小的放热反应,因此根据平衡移动原理在温度不变的情况下采取可增大CO浓度,及时移走Ni(CO)4,加压的方法等提高产率;
(2)根据题意,反应的Ni为1 mol,则生成Ni(CO)4为1 mol,反应速率为1/(2×10)=0.05mol·L-min-;
(3)反应(2)是正向气体体积增大的吸热反应,则,降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆【Ni(CO)4】均减小;根据反应⑴⑵的特点可提纯粗镍。
【考点定位】 本题考查化学反
本题难度:一般