微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂发生如下反应:2SO2(气)+O2(气)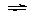 2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
参考答案:80
本题解析:由阿伏加德罗定律的推论可知: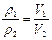 ,V2=0.9×(3+1)=3.6体积。
,V2=0.9×(3+1)=3.6体积。
设参加反应的SO2为x体积,由差量法
2SO2 + O2
本题难度:一般
2、填空题 在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
?
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
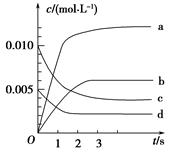
(2)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)??? b.容器内压强保持不变
c.v逆(NO)=2v正(O2)?????? d.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a.及时分离出NO2气体?? b.适当升高温度
c.增大O2的浓度???? d.选择高效催化剂
参考答案:(1)b 1.5×10-3 mol·(L·s)-1 (2)b
本题解析:(1)NO2的起始浓度为c(NO2)=0,2 s时c(NO2)可根据图表中n(NO)的变化量求解,c(NO2)=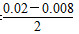 mol·L-1=0.006 mol·L-1,故答案选b。由图表可求0~2 s内v(NO)= mol·L-1=0.006 mol·L-1,故答案选b。由图表可求0~2 s内v(NO)= 本题难度:一般 本题难度:一般
3、选择题 在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.A的密度
D.气体总物质的量
参考答案:A、可逆反应:A(s)+2B(g)?C(g)+D(g),反应
本题解析:
本题难度:一般
4、填空题 在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应应:
A(g) B(g)+C(g)??△H ="+85.1" kJ· mol-1 B(g)+C(g)??△H ="+85.1" kJ· mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
| 0
| 1
| 2
| 4
| 8
| 16
| 20
| 25
| 30
| 总压强p/100kPa
| 4.91
| 5.58
| 6.32
| 7.31
| 8.54
| 9.50
| 9.52
| 9.53
| 9.53
?
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为?????????????。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为???????????????????。
平衡时A的转化率为????????????,列式并计算反应的平衡常数K ??????????????????。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=?????????mol,n(A)= ?????????mol。
②下表为反应物A浓度与反应时间的数据,计算a=??????????
反应时间t/h
| 0
| 4
| 8
| 16
| c(A)/(mol·L-1)
| 0.10
| a
| 0.026
| 0.0065
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是?????????????,由此规律推出反应在12h时反应物的浓度c(A)为????????mol·L-1
参考答案:(1)升高温度、降低压强
(2)α(A)=(![]()
本题解析:
试题分析:(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A) mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
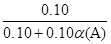 本题难度:一般 本题难度:一般
5、选择题 本题所列的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是?????????????????????????????(????? )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
参考答案:C
本题解析:略
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772