微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
回答下列问题:
⑴该反应化学平衡常数的表达式:K=????;
⑵该反应为???????(填“吸热”或“放热”)反应;
⑶下列说法中能说明该反应达平衡状态的是????????
A、容器中压强不变???????? B、混合气体中c(CO)不变
C、混合气体的密度不变???? D、c(CO) = c(CO2)
E、化学平衡常数K不变????? F、单位时间内生成CO的分子数与生成H2O的分子数相等
⑷某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为???。
参考答案:⑴K=c(CO)·c(H2O)/c(CO2)·c(H2);⑵
本题解析:
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数K=c(CO)·c(H2O)/c(CO2)·c(H2)。
(2)根据表中数据可知,随着温度的升高,平衡常数逐渐增大,这说明升高温度平衡向正反应方向移动,因此正反应是吸热反应。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以B正确。该反应是
本题难度:一般
2、填空题 甲酸甲酯水解反应方程式为:HCOOCH3 + H2O  ?HCOOH + CH3OH – Q(Q>0) ?HCOOH + CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如左下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如右下图:
组分
| 物质的量/mol
| HCOOCH3
| 1.00
| H2O
| 1.99
| HCOOH
| 0.01
| CH3OH
| 0.52
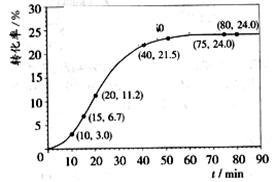
上述反应的平衡常数表达式为K=_______________________。
计算15~20min范围内:甲酸甲酯的减少量为??????????mol,甲酸甲酯的平均反应速率为 ??????mol/min;80~90min范围内甲酸甲酯的平均反应速率为___________ mol/min。
依据以上数据,推断该反应在10min后反应速率迅速加快的原因:?????????。
其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
参考答案: 本题解析: 本题解析:
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,平衡常数 。 。
(2)根据图中的转化率可知,15min时甲酸甲酯的转化率是6.7%,则消耗甲酸甲酯的物质的量是0.067mol。20min时甲酸甲酯的转化率
本题难度:困难
3、选择题 恒温恒容条件下,发生化学反应H2(g)+I2(g)?2HI(g),下列选项中不能作为达平衡标志的是( )
A.混合气体颜色不再变化
B.单位时间内生成nmol氢气的同时生成nmol碘蒸气
C.若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化
D.2V正(H2)=V逆(HI)
参考答案:A.混合气体颜色不再变化,说明各物质的浓度不再发生变化,反应
本题解析:
本题难度:一般
4、选择题 在一定温度下,可逆反应X(g)+3Y(g)═2Z(g)达到平衡的标志是( )
A.Z生成的速率与X消耗的速率相等
B.单位时间生成amolX,同时生成3amolY
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1:3:2
参考答案:A.对可逆反应X(g)+3Y(g)═2Z(g)来说,Z生成的
本题解析:
本题难度:一般
5、填空题 在恒温时,向某密闭容器中通入2 mol X和1 mol Y气体,发生如下反应:2X(g)+Y(g) 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。? 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。?
(1)与上述平衡保持同温、同压,若向密闭容器中通入4 mol X(g)和2 mol Y(g),达到平衡,则Z的体积分数为_______;平衡时,气体X的体积分数为_______。?
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和Y(g)的物质的量分别记为n(X)=m、n(Y)=n,并满足平衡时Z的体积分数为0.4,则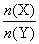 的取值范围为_______。 的取值范围为_______。
参考答案:(1)w(Z)=0.4?? 40%
(2)0.5<
本题解析:体积不变时,体系的压强相等时,该平衡不发生移动,故向密闭容器中通入4molX(g)和2molY(g),达到平衡,该平衡与原平衡相同;若要满足“向密闭容器中通入X(g)和Y(g)的物质的量分别记为n(X)=m、n(Y)=n,并满足平衡时Z的体积分数为0.4,”则平衡时该平衡与原平衡为等效平衡。等效平衡即要求配料相等,则m的最大值为5mol,此时n必须为0.5 mol,能够使得两者的物质的量之比为2∶1。得答案为0.5< 本题难度:简单 本题难度:简单
|
|