1200
K
0.6
0.9
1.0
1.7
2.6
请回答:
(1)该反应为______(填“吸热”或“放热”)反应.
(2)该反应的化学平衡常数表达式为K=______.
(3)能说明该反应达到化学平衡状态的是______(填字母).
a.容器中压强不变?????????????????b.混合气体中?c(CO)不变
c.υ正(H2)=υ逆(H2O)???????????d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10mol充入该容器中,达到平衡后,测得?c(CO)=0.0080mol/L,则CO2的转化率为______.
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为______℃.
参考答案:(1)升高温度,化学平衡常数增大,说明平衡向正反应方向移动,
本题解析:
本题难度:一般
2、选择题 在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)?CO(g)+H2(g);
乙:CO(g)+H2O(g)?CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变 ⑦单位时间内,消耗水质量与生成氢气质量比为9:1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤
B.③④⑥
C.⑥⑦
D.④⑤
参考答案::①混合气体平均相对分子质量不再改变,由于乙反应的两边气体的
本题解析:
本题难度:一般
3、选择题 在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)?fC(g)+D(g),能表明反应已达平衡状态的是( )
A.混合气体的压强不变
B.混合气体的密度不变
C.单位时间内生成nmolC的同时生成nmolD
D.气体总物质的量不变
参考答案:A、混合气体的压强不变时,对于反应前后气体体积不变的反应无意
本题解析:
本题难度:简单
4、计算题 将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2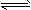 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题: 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率(用百分数表示)。
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
参考答案:(1)bc
(2)消耗O2的物质的量:0.7 mol
本题解析:
本题难度:一般
5、简答题 ( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的交化如下表:
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
(1)写出该反应的平衡常数表达式:K=______,已知:K(300℃)>K(350℃),该反应是______反应(填“放热”或“吸热”);
(2)如图中表示NO2的变化的曲线是______,用O2的浓度变化表示从0~2s内该反应的平均速率v=______;
(3)能说明该反应已经达到平衡状态的是______
a.?v(NO2)=2v(O2);b.容器内压强保持不变;c.v逆(NO)=2v正(O2);d.容器内物质的密度保持不变.
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离出NO2气体;b.适当升高温度;c.增大O2的浓度;d.选择高效的催化剂.
( II)用石墨做电极电①稀H2SO4??②K2SO4溶液??③CuCl2溶液??④CuSO4?溶液?⑤KOH溶液.
(1)阴阳极都有气体产生,且体积比(相同条件下)为2:1的是______(填序号,下同),其阳极的电极反应式都是______,总反应的化学方程式是______.
(2)阴极.阳极都有气体产生,其中溶液的pH变小的是______,pH变大的是______.
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是______,其总反应的化学方程式是______.
参考答案:(Ⅰ)、(1)可逆反应2NO(g)+O2(g)?2NO2(g
本题解析:
本题难度:一般
|