微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:

(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒上产生现象是 ,试用电极反应式表示该现象: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为: 。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为: 。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸
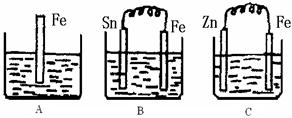
(1)写出A中离子反应方程式:
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为
(4)反应完成后三个烧杯中液体质量大小顺序为:A B C (用<、=、>连接)。
参考答案:(I)(1)负极(1分)有无色气泡析出(1分) 2H++2e
本题解析:(I)(1)Zn+CuSO4=ZnSO4+Cu↑
负极:Zn-2e-=Zn2+ 正极:2H++2e-=H2↑
(2)Zn+H2SO4=ZnSO4+H2↑
负极:Zn-2e-=Zn2+ 正极:Cu2++2e-=Cu↑
(3)H2 ~ Zn ~ Cu可知。
(II)B中铁为负极,Sn为正极,2H++2e-=H2↑, pH增大。
C中锌为负极:Zn+H2SO4=ZnSO4+H2↑可求得:
0.25mol 5.6L
c(H2SO4)=0.5mol·L-1
(4)A、B中均发生反应:Fe+H2SO4=FeSO4+H2↑;C中为::Zn+H2SO4=ZnSO4+H2↑
比较可知:A、B硫酸中增加1molFe,析出1molH2,质量增加54g;而C中硫酸中增加1molZn,析出1molH2,质量增加63g;
本题难度:一般
2、填空题 近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的??????极(填“正”或“负”),负极反应式为?????.用这种方法处理SO2废气的优点是?????.
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
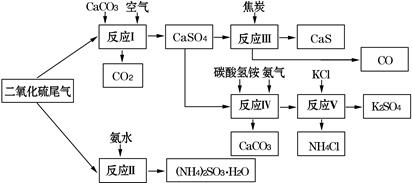
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是?????.
②下列有关说法正确的是?????.
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是?????.
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式?????.
参考答案:(共15分)
(1) 负(2分)????SO2+2H2
本题解析:
试题分析:
(1)原电池负极发生氧化反应,正极发生还原反应,依据元素化合价变化可知,二氧化硫中硫元素化合价升高,失电子发生氧化反应。因此应将SO2通入电池的负极,电极反应为:SO2+2H2O-2e-=SO42-+4H+;此方法的优点是污染小,生成产物可以循环利用,可以回收有效能;
(2)①向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,防止亚硫酸根被氧化,以更好的得到亚硫酸铵晶体;
②A、依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙,正确;
B、依
本题难度:困难
3、填空题 (3分)用导线将锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,此电池的负极是?????,正极的电极反应式是???????????????????。
参考答案:略
本题解析:略
本题难度:简单
4、选择题 关于右图所示的原电池,下列说法不正确的是???
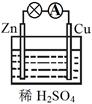 ?????????????????
?????????????????
A.Cu为正极,Zn为负极
B.该装置能将化学能转化为电能
C.电子由铜片通过导线流向锌片
D.正极反应为 2H+ + 2e- H2↑
H2↑
参考答案:C
本题解析:
试题分析:锌的金属性强于铜,所以锌是负极,失去电子。铜是正极,溶液中的氢离子得到电子生成氢气,所以正确的答案选C。
点评:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可以进行有关的判断。
本题难度:一般
5、选择题 将铜片和石墨棒用导线相连(其间连有电流表),并同时插入Fe2(SO4)3溶液中,下列现象中不可能出现的是? [???? ]
A.铜片质量减少
B.石墨棒质量增加
C.电流表指针偏转
D.溶液显蓝色
参考答案:B
本题解析:
本题难度:一般