微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如下图所示,该电池放电时,右槽中的电极反应为:V2+ - e- = V3+,下列说法正确的是

A.放电时,右槽发生还原反应
B.充电时,阴极电解液pH升高
C.充电时,每转移lmol电子,n(H+)的变化量为l mol
D.放电时,左槽的电极反应式:VO2++ 2H+ + e-= VO2++ H2O
参考答案:D
本题解析:
试题分析:原电池中,正极发生氧化反应,负极发生还原反应,根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理和电解池的工作原理进行分析;右槽是负极,发生氧化反应,A错误;左槽是正极,发生的电极反应式:VO2++ 2H+ + e-  VO2++ H2O,D正确;负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电池反应为VO2++V2++2H+
VO2++ H2O,D正确;负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电池反应为VO2++V2++2H+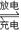 VO2++V3++H2O,所以充电时阴极电极反应为V3++e-
VO2++V3++H2O,所以充电时阴极电极反应为V3++e-
本题难度:一般
2、填空题 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g) CH3OH(g) △H1(反应1)该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为
CH3OH(g) △H1(反应1)该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol(反应2)
H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ/mol(反应3)
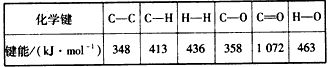
某些化学键的键能数据如下表:
|
请回答下列问题:
(1)反应1的焓变△H1=________。
(2)与CO和H2相比,甲醇作为汽车动力燃料的优点是________________。
(3)反应1的平衡常数表达式为____________为提高甲醇的产率,可以采取的措施有________________(写出3点)。既能提高产率,又能提高反应速率的措施是________________________。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电 动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:

①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质的名称(或化学式)。
②负极的电极反应式为____________________。
参考答案:(1) -116 kJ/mol-1
(2)单位体积供
本题解析:
本题难度:一般
3、选择题 下列图示与对应的叙述一定正确的是(??)
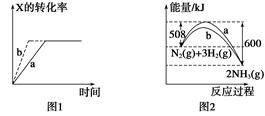
A.图1所示,反应:X(g)+2Y(g)  3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
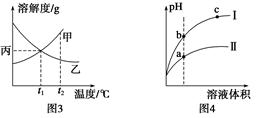
C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
参考答案:B
本题解析:A项,反应前后化学计量数不变,b曲线可能是加压或加催化剂的情况,错误;B项,该反应为放热反应,加入催化剂能降低反应所需活化能,正确;C项,升温后,甲的溶解度增大,变为不饱和溶液,其质量分数不变,但乙溶液有晶体析出,质量分数减小,错误;D项,在pH相同的盐酸和醋酸中,c(H+)相同,但是醋酸中仍含有大量CH3COOH分子,稀释相同倍数时,醋酸继续电离,pH较小对应曲线为Ⅱ,导电性应为a>b>c,错误。
本题难度:一般
4、填空题 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:

请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是 ,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是 。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、V)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O +V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
+V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是 。
a.V、VO2+混合液
b.V3+、V2+混合液
c.V溶液
d.VO2+溶液
e.V3+溶液
f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是 。
参考答案: (1)电解质溶液 抑制硫酸亚铁的水解
(2)V+2H
本题解析:
试题分析: (1)传统的铜锌原电池中,锌与酸反应生成氢气,故硫酸为电解质溶液;硫酸亚铁容易水解,且水解显酸性,加入少量硫酸,可以抑制其水解变质。(2)正极反应是还原反应,由电池总反应可知放电时的正极反应为V+2H++e- VO2++H2O;充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应。(3)充电时阳极反应式为VO2++H2O-e-
VO2++H2O;充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应。(3)充电时阳极反应式为VO2++H2O-e- V+2H+,故充电完毕的正极电解液为V溶液,而放电完毕的正极电解液为VO2+溶液,故正极电解液可能是选项acd。(4)充电和放电过程中,正极电解液与负极电解液不能混合,起平衡电荷作用的是加入的酸,故H+可以通过隔膜。
V+2H+,故充电完毕的正极电解液为V溶液,而放电完毕的正极电解液为VO2+溶液,故正极电解液可能是选项acd。(4)充电和放电过程中,正极电解液与负极电解液不能混合,起平衡电荷作用的是加入的酸,故H+可以通过隔膜。
考点:燃料电池
本题难度:一般
5、填空题 (10分)
汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
N2+2CO2。
(1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为:
K=???????????。
(2)已知:CO(g)+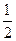 O2(g)=2CO2(g)???△H=一283 kJ/mol
O2(g)=2CO2(g)???△H=一283 kJ/mol
N2(g)+O2(g)="2" NO(g)???△H="+180" kJ/mol
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=?????kJ/mol。
N2(g)+2CO2(g)△H=?????kJ/mol。
(3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是?????????????????。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是?????????????????。
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③在单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2和CO2的方向移动
(4)下列说法正确的是??????????
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳 出行
出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(5)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收( 不考虑CO2溶于水),生成NaCO3的物质的量为?????mol。
参考答案:
(1) 本题解析:略
本题解析:略
本题难度:一般