微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应①X(g)+2Y(g) 2Z(g)?、②2M(g)
2Z(g)?、②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示

下列判断正确的是[???? ]
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时,X的转化率为5/11
D.在平衡(I)和平衡(II)中M的体积分数相等
参考答案:C
本题解析:
本题难度:一般
2、选择题 在一密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,探讨温度对反应的影响,实验结果如下图所示(注:T1,T2均大于300 ℃),下列说法正确的是????????????? ( )。
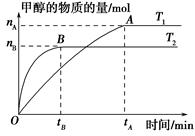
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=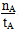 mol·L-1·min-1
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时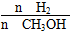 增大
增大
参考答案:D
本题解析:v(CH3OH)=Δc/Δt=nA/(VtA)mol/(L·min)(其中V指容器的容积),A项错误;T1,T2两曲线比较,T2先达到平衡,故温度:T1<T2,平衡状态下,T1→T2,温度升高,n(CH3OH)减小,平衡向左移动,K值减小,B项错误;逆反应为吸热反应,C项错误;n(H2)增大,n(CH3OH)/n(H2)减小,D项正确。
本题难度:一般
3、选择题 在373K时,把0.5mol N2O4通入体积为5 L的真空密闭容器中,立即出现棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始的1.6倍。 下列说法正确的是 [???? ]
A.前2s,以N2O4的浓度表示的平衡反应速率为0.01 mol·L-1·s-1
B.在2s时体系内的压强为开始时的1.1倍
C.在平衡时体系内含N2O4 0.25mol
D.平衡时,如果压缩容器体积,则可提高N2O4的转化率
参考答案:B
本题解析:
本题难度:一般
4、填空题 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
回答下列问题:
(1)该反应的平衡常数表达式K=????????,△H ????0(填“>”“<”或“=”);
(2)830℃时,向一个5L密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)=????? mol·L-1,C的物质的量为?????????mol;若反应经一段时间后,达到平衡时A的转化率为
????????????,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ?????????????;
(3)判断该反应是否达到平衡的依据为???????(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 ?????????? A(g)+B(g)的平衡常数的值为 ??????????
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数表达式k=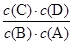 由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0, 由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为0.2mol/5L=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,
故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04???0.16?????0???????0
变化(mol/L):x????????x??????? x???????x
平衡(mol/L):0.04-x?? 0.16-x??x??????x
故x2/(0.04-x)( 0.16-x)=1,解得x=0.032
所以平衡时A的转化率为0.032/0.04×100%=80%
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,?b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,故答案为:c;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为1/0.4=2.5,
本题难度:一般
5、选择题 对于反应A+3B=2C+D来说,下列反应速率中最快的是 [???? ]
A.v(A)=0.3mol·L-1·min-1
B.v(B)=0.6mol·L-1·min-1
C.v(C)=0.5mol·L-1·min-1
D.v(D)=0.001mol·L-1·min-1
参考答案:A
本题解析:
本题难度:简单
|