微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H=-110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H=-157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。
(4)铁在潮湿的空气中发生吸氧腐蚀的电池反应方程式为 。
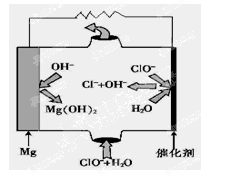
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_______________。
(6)工业上电解熔融氯化钠的方程式为 。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)由盖斯定律,可知
(2)根椐平衡常数的定义知: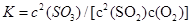
(3)甲烷被氧化,失去电子;电极反应式的书写要求,质量守恒,电荷守恒。
(4)铁在空气中接触氧气和水,被氧化为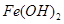 ;
;
(5)先写出电极反应方程式:
负极:Mg-2e-=Mg2+
正极:ClO-+2e-+H2O=Cl-+2OH-
因此总反应为:Mg+ClO-+H2O=Mg(OH)2↓+Cl-
(6)电解熔融的氯化钠:阴极:2Na++2e-=Na;阳极:2Cl
本题难度:一般
2、选择题 已知:H+(aq)+OH-(aq)→H2O(l)+57.3kJ.对于下列反应:
①HCl(aq)+NH3?H2O(aq)→NH4Cl(aq)+H2O(l)+a?kJ
②HCl(aq)+NaOH(s)→NaCl(aq)+H2O(l)+b?kJ
③HNO3(aq)+KOH(aq)→KNO3(aq)+H2O(l)+c?kJ
则a、b、c三者的大小关系为( )
A.a>b>c
B.b>c>a
C.a=b=c
D.无法比较
参考答案:B
本题解析:
本题难度:简单
3、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是 ;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol
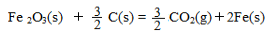 △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g) △H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是 ,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
参考答案:(1)NO3- + Al +H2O→ Al(OH)3 + N
本题解析:
试题分析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al为还原剂,则Al(OH)3为氧化产物,再根据电荷守恒和原子守恒可得:NO3- + Al +H2O→ Al(OH)3 + N2 + OH-;Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知,x×(3-0)=y×(5-0),解得x:y=5:3,所以被氧化与被还原的元素的物质的量之比为5∶3。
(2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,正极反应为2H2O+O2+4e-=4OH-;Al元素由0价升高为+3价,则 Al~3e?,所以消耗13.5 g Al时转移电子:13.5g÷27g/mol×3=1.5mol。
(3)首先写出化学方程式并注明各物质的状态,然后根据盖斯定律求出?H,?H="1/2" ?H1+?H2
本题难度:困难
4、填空题 (12分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
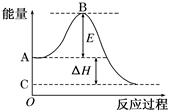
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示: _____;C点表示: (填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。
参考答案:(1)反应物的总能量;生成物的总能量(2)无 (3
本题解析:(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义。
(2)E为活化能与反应热无关,但是用催化剂可以降低活化能。
(3)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1=-198kJ/mol
本题难度:一般
5、填空题 氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
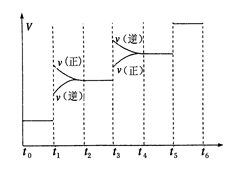
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为
参考答案:(1) H2(g)+ 1/2O2(g)=H2O(l);ΔH=
本题解析:
试题分析:(1)1g氢气的物质的量是0.5mol,燃烧0.5mol氢气放出142.9kJ热量,所以燃烧1mol氢气放出285.8kJ热量,所以氢气的燃烧热化学反应方程式为:H2(g)+1/2O2(g)=H2O(1)△H=-285.8kJ/mol;
(2)N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol;反应是放热反应,反应前后气体体积减小,①依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;表示平衡混合物中NH3的含量最高的一段时间是t2-t3;
② N2(g)+3H2(g)?2NH2(g)
开始 2amol/L 4amol/L 0
反应 amol/L 3amol/L 2amol/L
平衡 amol/L amol/L 2amol/L
所以化学平衡常数K=(2amol/L)2/(amol/L)?(amol/L)3=4/a2(L/mol)2,
考点:热化学方程式;化学平衡常数的含义;化学平衡的调控作用
本题难度:困难