微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3?kJ?mol-1,则含40.0?g?NaOH的稀溶液与稀醋酸完全中和,放出小于57.3?kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6?kJ?mol--1,则氢气的燃烧热为241.8kJ?mol-1
C.已知2C(s)+2O2(g)=2CO2(g)△H=a???2C(s)+O2(g)=2CO(g)△H=b,则a>b
D.已知P?(白磷,s)=P?(红磷,s)△H<0,则白磷比红磷稳定
参考答案:A
本题解析:
本题难度:简单
2、选择题 ①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,
②1 mol I2蒸气中化学键断裂时需要吸收151 kJ的能量,
③由H原子和I原子形成1 mol HI分子时释放299 kJ的能量。
下列热化学方程式正确的是 [???? ]
A.2HI(g)=H2(g)+I2(g);ΔH=+11 kJ·mol-1
B.H2(g)+I2(g)=HI(g);ΔH=-11 kJ·mol-1
C.H2(g)+I2(g)=2HI(g);ΔH=+288 kJ·mol-1
D.H2(g)+I2(g)=HI(g);ΔH=-114 kJ·mol-1
参考答案:A
本题解析:
本题难度:简单
3、填空题 (14分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
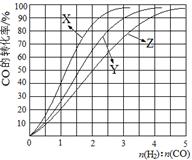
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母) 。
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
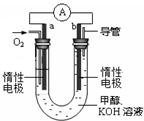
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
参考答案:(每空2分,共14分)(1)CH3OH(l)+ O2(g)
本题解析:
本题难度:困难
4、选择题 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(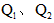 均为正值):
均为正值):

|
有关上述反应的叙述正确的是[???? ]
A.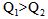
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出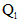 热量
热量
D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
参考答案:AD
本题解析:
本题难度:一般
5、选择题 已知:H2(g)+F2(g)=2HF(g) △H=- 270 kJ·mol-1,下列说法不正确的是?
[???? ]
A.44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ
C.相同条件下,1 mol氢气与1 mol氟气的能量总和高于2mol氟化氢气体的能量
D.2 mol H-F键的键能比1mol H-H键和1mol F-F键的键能之和小270 kJ
参考答案:A
本题解析:
本题难度:简单