?
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
_______________________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________________。
参考答案:(2)①Br2 ②Fe3+ (3)d 溶液呈红色 b CCl
本题解析:略
本题难度:一般
2、实验题 (17分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
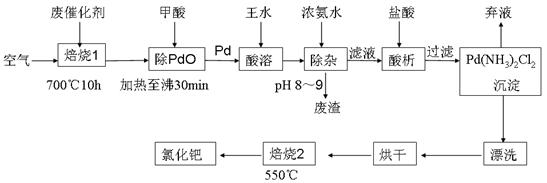
(1)甲酸还原氧化钯的化学方程式为 ???????。
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式)。
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为 ????????
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
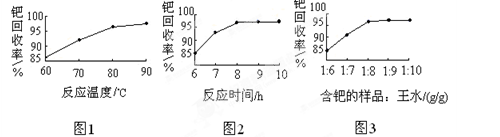
(4)钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯的适宜条件是:反应温度为 ???????????,反应时间约为 ?,含钯的样品与王水的质量比为 ????。
(5)700℃“焙烧1”的目的是 ????????????????????????????????, 550℃“焙烧2”的目的是 ?????????????????。
参考答案:(1)PdO+HCOOH 本题解析: 本题解析:
试题分析:(1)甲酸 分子中含有醛基,有还原性,能把氧化钯还原为Pd,它本身被氧化为碳酸,反应的化学方程式为PdO+HCOOH 分子中含有醛基,有还原性,能把氧化钯还原为Pd,它本身被氧化为碳酸,反应的化学方程式为PdO+HCOOH Pd+CO2↑+H2O;(2)王水有强的氧化性,会把Fe氧化为Fe3+,加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素也会形成Fe(OH)3沉淀。(3)①王水把Pb氧化时,其中的硝酸被还原得到无色、有毒的气体B是NO;②Pd:42.4÷106.4=0.4;H:0.8÷1=0.8.所以Pd:H=1:2.由于Pd是+2价,H为+1价,根据化合物的正负化合价的代数和为O,所以还应该含有4个-1价的阴离子。它的物质的量为0.4mol×4=1.6mol.因此其相对原子质量为:(1-42.4%-0.8%)÷(0.4×4)=35.5。所以该离子是Cl-。A的化学式为H2PdCl4;(4)由题目提供的示意图可知则王水溶解钯的适宜的反应温度为80~90℃;反应时间约为8小时,含钯的样品与王水的质量比为1:8。(5)700℃“焙烧1”的目的是除去废Pd催化剂中的活性炭及有机物杂质;550℃“焙烧2”的目的是将Pd(NH3)2Cl2煅烧使之转变为PdCl2。2)的反应原理、反应条件的选择、化学式的确定、方程式的书写。 Pd+CO2↑+H2O;(2)王水有强的氧化性,会把Fe氧化为Fe3+,加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素也会形成Fe(OH)3沉淀。(3)①王水把Pb氧化时,其中的硝酸被还原得到无色、有毒的气体B是NO;②Pd:42.4÷106.4=0.4;H:0.8÷1=0.8.所以Pd:H=1:2.由于Pd是+2价,H为+1价,根据化合物的正负化合价的代数和为O,所以还应该含有4个-1价的阴离子。它的物质的量为0.4mol×4=1.6mol.因此其相对原子质量为:(1-42.4%-0.8%)÷(0.4×4)=35.5。所以该离子是Cl-。A的化学式为H2PdCl4;(4)由题目提供的示意图可知则王水溶解钯的适宜的反应温度为80~90℃;反应时间约为8小时,含钯的样品与王水的质量比为1:8。(5)700℃“焙烧1”的目的是除去废Pd催化剂中的活性炭及有机物杂质;550℃“焙烧2”的目的是将Pd(NH3)2Cl2煅烧使之转变为PdCl2。2)的反应原理、反应条件的选择、化学式的确定、方程式的书写。
本题难度:一般
3、实验题 (14分)
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
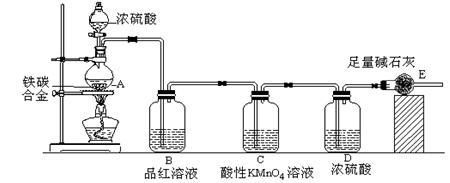
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;②?????。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式?????。
⑶B中的现象是:?????;C的作用是:?????。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为??????(写表达式)。
⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:?????。
⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)?????。
参考答案:(共14分)
本题解析:略
本题难度:一般
4、实验题 (10分)向溴水中加入足量乙醛溶液,可以观察到溴水褪色。对产生该现象的原因有如
下三种猜想:①溴水与乙醛发生了取代反应;②溴水与乙醛发生了加成反应③溴水将乙醛氧化成乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量
(1)方案一是否可行??????,理由???????????????????????????????????????
(2)假设方案二中测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=
????????mol,说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)=???????mol,说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)=???????mol,则说明溴水将乙醛氧化成乙酸。
参考答案:(1)不可行;乙醛与溴水发生取代反应或氧化反应后溶液均呈酸性
本题解析:题目中,猜想有三种:溴水分别与乙醛发生取代、加成及氧化。方案一中,无论取代(生成HBr)或氧化乙醛(生成CH3COOH),均使反应后溶液显酸性,故不可行。方案二中,由于发生三种反应后溶液中Br-的量存在差异,故方案二可行;且由于乙醛是足量的,溴水中的溴全部参与反应:取代反应中生成n(Br-)="a" mol,加成反应中n(Br-)="0" mol,氧反应中n(Br-)="2a" mol。
本题难度:一般
5、填空题 全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时入放A、B、C三支试管中进行研究。
(1)请你帮助该学生完成下列实验设计的内容:
编号
| 操作方法
| 实验目的
| A
| ?
| 探究铁在干燥空气中的生锈情况
| B
| 放入铁钉,注入蒸馏水浸没铁钉并用植物油液封
| ?
| C
| ?
| 探究铁在有空气和水时的生锈情况
(2)一周后,编号为________的试管中的铁钉最易生锈。证明铁生锈的条件是:???????????????????????????????????????????????????????????????。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在新疆吐鲁番比安装在昆明滇池海埂大坝??????????????(填“更易”或“更难”)生锈。
参考答案:(1)??
编号
操作方法
实验目的
本题解析:略
本题难度:简单
|
|