微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.05 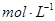 的醋酸溶液加水稀释时,下列说法正确的是(??? )
的醋酸溶液加水稀释时,下列说法正确的是(??? )
A.溶液中氢氧根离子的浓度增大了
B.c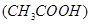 减小,电离平衡向生成醋酸分子的方向移动?
减小,电离平衡向生成醋酸分子的方向移动?
C.平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少
D.电离程度增大,c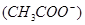 也增大了
也增大了
参考答案:A
本题解析:
试题分析:醋酸是弱酸,存在电离平衡CH3COOH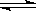 CH3COO-+H+。稀释促进电离,氢离子的个数增加,但氢离子浓度降低,,所以溶液中氢氧根离子的浓度增大,A正确,B和C以及选项D都是错误的,答案选A。
CH3COO-+H+。稀释促进电离,氢离子的个数增加,但氢离子浓度降低,,所以溶液中氢氧根离子的浓度增大,A正确,B和C以及选项D都是错误的,答案选A。
考点;考查外界条件对电离平衡的影响
点评:在稀释醋酸时,需要搞清楚促进电离,但溶液的酸性不
本题难度:一般
2、选择题 将0.1 mol/L醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小
B.水的离子积不变
C.醋酸电离平衡向左移动
D.溶液中c(H+)增大
参考答案:B
本题解析:
试题分析:醋酸是弱酸,存在电离平衡,电离平衡方程式是CH3COOH CH3COO-+H+。稀释促进电离,氢离子的数目增加,但氢离子的浓度是降低的。由于温度是不变的,所以水的离子积常数是不变的,所以溶液中c(OH-)增大,答案选B。
CH3COO-+H+。稀释促进电离,氢离子的数目增加,但氢离子的浓度是降低的。由于温度是不变的,所以水的离子积常数是不变的,所以溶液中c(OH-)增大,答案选B。
点评:本题容易错选D,这是由于氢离子的浓度与氢离子的物
本题难度:一般
3、选择题 HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是
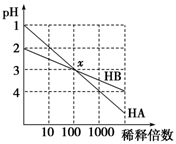
A.HA是一种强酸
B.x点,[A-]=[B-]
C.HB是一种弱酸
D.原溶液中HA的物质的量浓度为HB的10倍
参考答案:D
本题解析:
试题分析:A、根据图像可知HA稀释前pH=1,稀释100倍后pH=3,这说明在稀释过程中氢离子的物质的量不变,因此HA是强酸,A正确;B、x点两种溶液的pH相等,则根据电荷守恒可知[H+]=[OH-]+[A-]、[H+]=[OH-]+[B-],所以x点,[A-]=[B-],B正确;C、稀释前HB的pH=2,稀释100后pH=3,这说明在稀释过程中溶液中氢离子的物质的量是增加的,因此溶液中存在电离平衡,所以HB是弱酸,C正确;D、稀释前HA的浓度是0.1mol/L。但由于HB是弱酸,不能确定HB的浓
本题难度:一般
4、填空题 在H2S溶液中,通入或加入少量下列物质:①O2?②Cl2?③SO2?④CuSO4,能使溶液中的c(H+)增大的是______________。
参考答案:②④
本题解析:H2S是弱电解质,在溶液中存在如下平衡:H2S H++HS-,HS-
H++HS-,HS- H++S2-。当加入少量CuSO4时,Cu2+会
H++S2-。当加入少量CuSO4时,Cu2+会
本题难度:简单
5、选择题 下列物质中属于电解质的是
A.CuSO4
B.Al
C.石墨
D.蔗糖
参考答案:A
本题解析:分析:电解质是指:该物质是化合物,溶于水溶液中或在熔 融状态下就能够导电,是自身电离,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质,据此即可解答.
解答:A.硫酸铜水溶液中或在熔融状态下有自由移动的铜离子和硫酸根离子,能导电,硫酸铜是化合物,是电解质,故A正确;
B.Al是金属是单质,能导电,它既不是电解质也不是非电解质,故B错误;
C.石墨虽能导电,但它是单质,它既不是电解质也不是非电解质,故C错误;
D.蔗糖是化合物,在水溶液中和熔融状态下只存在蔗糖分子,没有自由移动的离子,所以不能导电,是非电解质,故D错误;
故选A.
点评:本题是对基本概念电解质的考查,题目难度不大,平时学习注意概念的辨析、基础知识的积累.
本题难度:一般