微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式中,错误的是( ? )
A.Na2CO3═2Na++CO32-
B.H2SO4═2H++SO42-
C.Ca(OH)2═Ca2++2(OH)-
D.FeCl3═Fe3++3Cl-
2、选择题 0.1 mol?L-1 KHS溶液中下列表达式不正确的是( )
A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-)
B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.c(HS-)+ c(S2-)+ c(H2S)=" 0.1" mol?L-1
D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)
3、填空题 (12分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4- + 5H2C2O4 +6H+ =2Mn2+ +10CO2↑ +8H2O
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别
| 10%硫酸溶液的体积/mL
| 温度/℃
| 其他物质
|
Ⅰ
| 2mL
| 20
| 无
|
Ⅱ
| 2mL
| 20
| 10滴饱和MnSO4溶液
|
Ⅲ
| 2mL
| 30
| 无
|
Ⅳ
| 1mL
| 20
| 1mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,应使用实验 和 (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,应使用实验 和 。
(2)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 。
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体。
②将WgNa2C2O4配成100 mL标准溶液,量取20.00 mL置于锥形瓶中,
酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。
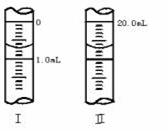
③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的浓度为________ (填表达式,用W表示)。
4、实验题 (9分)用中和滴定法测定某烧碱的浓度。请回答在主要操作过程中的有关问题:
(1)将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。将0.20mol/L的盐酸标准溶液装入酸式滴定管,滴定时,锥形瓶中加2—3滴 作为指示剂;滴定过程中,左手控制活塞,右手旋转摇动锥形瓶,眼睛应注视 ,
当 时即为滴定终点。有关数据如下:
滴定序号
| 待测溶液体积(单位:mL)
| 所消耗盐酸体积(单位:mL)
| 滴定前读数
| 滴定后读数
| 消耗盐酸体积
| 1
| 20.00
| 0.50
| 20.60
| V(平)=
________
| 2
| 20.00
| 6.00
| 26.00
(2) 计算:测得NaOH溶液的浓度为____________mol/L,烧碱样品的纯度为
(3)若该学生测定值偏大了,则引起测定误差的可能原因是_______________________
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
5、选择题 常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比
A.11∶1
B.9∶1
C.1∶11
D.1∶9
|
|
网站客服QQ: 960335752 - 14613519 - 791315772