微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l)?? ΔH2?=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)? ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5 Q2-1.5 Q1-0.5Q3
D.1.5 Q1-0.5 Q2+0.5Q3
参考答案:D
本题解析:试题分析:①H2O(g)═H2O(l)△H1=-Q1kJ?mol-1,②C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1,③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1,根据盖斯定律可知,
①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(3Q1-Q2+Q3)kJ/mol,
即1mol液态酒精完全燃烧并恢复至室温,则放出的热量为(3Q1-Q2+Q3)kJ,则0.5mol液态酒精完
全燃烧并恢复至室温,则放出的热量为0.5×(3Q1-Q2+Q3)kJ=1.5Q1-0.5Q2+0.5Q3。
考点:用盖斯定律进行有关反应热的计算
本题难度:简单
2、选择题 下列反应的离子方程式错误的是
A.硫酸铝中加入过量浓氨水:Al3++4OH-==AlO2-+2H2O
B.铜跟浓硝酸反应:Cu+2NO3-+4H+==Cu2++2NO2↑+2H2O
C.实验室用大理石跟稀盐酸反应制二氧化碳气体:CO32-+2H+==CO2↑+H2O
D.用氯化铁溶液制作印刷电路板:Cu+2Fe3+==Cu2++2Fe2+
参考答案:AC
本题解析:氢氧化铝虽是两性氢氧化物,但不能与弱酸、弱碱反应,铝离子在和足量氨水反应时仍然生成氢氧化铝沉淀,故A 错误;碳酸钙是常见的难溶物,在离子方程式的书写中要拆开,C错误。
本题难度:简单
3、选择题 关于高中化学苯:1866年,凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列哪些事
①苯不能使溴水褪色????????????????
②苯能与H2发生反应
③溴苯没有同分异构体??????????????
④邻二溴苯只有一种
A.①②
B.①③
C.①④
D.②④
参考答案:C
本题解析:若苯分子是单、双键交替的正六边形平面结构,那么苯就一定能使溴水褪色,邻二溴苯就有2种结构。故答案是C。
本题难度:困难
4、填空题 次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
参考答案:(1)Ni2++H2PO2+H2O=Ni+H2PO3+2H+
本题解析:
试题分析:观察反应式1可知镍从+2价变成0价,化合价降了2,H2PO2-中的P为+1价变为H2PO3-中的P+3价,化合价升了2,据得失电子总数相等的原则,在镍和H2PO2-不需要乘以任何的数。再据原子个数守恒可知,左边反应物只有两个氧,而右边有三个,因此在反应物中肯定还有一个氧原子,而题目中说,该反应时在酸性条件下进行,所以反应物中应该是水参与了反应,所以可以得出Ni2++H2PO2+H2O=Ni+H2PO3+2H+
H2PO2- 中P化合价升高,因此做还原剂,而Ni2+化合价降低做氧化剂,所以被还原的元素是镍
6H2PO2- +2H+ →2P+4H2PO3-+3H2↑ 6H2PO2-中6个P的化合价由+1变成2个0价的P和4个+3价的4H2PO3中的P,因此生成4摩尔的H2PO3-电子转移是4乘以2,则生成1摩尔的H2PO3-电子转移的物质的量为2摩尔。
Ni2++H2PO2+H2O=Ni+H2PO3+2H+ 可知生成一摩尔的Ni则同时生成1摩尔的H2PO3-6H2PO2- +2H+ →2P+4H2PO3-+3H2↑可知生成1摩尔的P则同时生成2摩尔的H2PO3-所以总共生成3摩尔H2PO3-
由制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。可知
①2Na+Na2O2= 2Na2O ②10K+2KNO3=6K2O+N2
考点:考查化学式的配平及氧化还原反应及物质的量的相关计算的知识
本题难度:困难
5、选择题 把有机物 氧化为
氧化为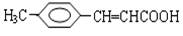 ,所用氧化剂最合理的是( )
,所用氧化剂最合理的是( )
A.O2
B.酸性KMnO4
C.银氨溶液
D.溴水
参考答案:C
本题解析:
试题分析:比较两种有机物,前者中的醛基变为羧基,而碳碳双键不被氧化,所以选择弱氧化剂银氨溶液或新制氢氧化铜,答案选C。
考点:考查官能团的化学性质
本题难度:一般