微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用下列方法制取氢气,反应速率最大的是
A.冬天,块状锌与2 mol·L一1硫酸溶液反应
B.冬天,粉末状锌与2 mol·L一1硫酸溶液反应
C.夏天,块状锌与2 mol·L一1硫酸溶液反应
D.夏天,粉末状锌与2mol·L一1硫酸溶液反应
参考答案:D
本题解析:
试题分析:在其它条件相同的条件下,升高温度或增大反应物的浓度或增大反应物的接触面积,均可以加快反应速率,据此可知选项D正确,答案选D。
点评:该题是高考中的常见考点,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导。旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提高学生的应试能力。
本题难度:简单
2、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是( )
A.加入少量醋酸钾固体
B.加入少量稀NaOH溶液
C.加入少量NH4HSO4固体
D.加入少量Na2CO3浓溶液
参考答案:A.加入少量CH3COOK固体,使盐酸转化为醋酸,减小氢离子
本题解析:
本题难度:一般
3、填空题 某化学反应2A(g) B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号?时间
| 0
| 2
| 3
| 4
|
800
| ℃
| 800
| ℃
|
1
| 1.0
| c2
| c3
| 1.0
|
10
| 0.80
| 0.60
| 0.92
| 0.20
|
20
| 0.67
| 0.50
| 0.75
| 0.20
|
30
| 0.57
| 0.50
| 0.63
| 0.20
|
40
| 0.50
| 0.50
| 0.60
| 0.20
|
50
| 0.50
| 0.50
| 0.60
| 0.20
|
60
| 0.50
| 0.50
| 0.60
| 0.20
|
(1)实验1中, 反应在10至20分钟内平均化学反应速率为v(A)=______________。
(2)实验2中,A的初始浓度c2=______________mol·L-1,反应经20 min就达到平衡,可推测实验2中隐含的条件可能是_______________。
(3)若实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3______________v1(填“<”“>”或“=”=,且c3______________(填“<”“>”或“=”=1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应的正反应是______________(填“吸热”或“放热”反应)。理由是__________________________________________________________________。
参考答案:(1)0.013 mol·L-1·min-1
(2)1
本题解析:(1)v(A)=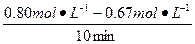 ="0.013" mol·L-1·min-1
="0.013" mol·L-1·min-1
(2)对比实验2与实验1,可知从10 min到20 min,实验1中A的浓度相同,说明是同一平衡状态,即c2="1.0" mol·L-1。又因实际反应的速率快,达平衡所需的时间短,说明反应中使用了催化剂。
(3)对比实验3与实验1,可知从
本题难度:简单
4、选择题 下列四个试管中,发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是(???? )?
试管
| 盐酸浓度
| 温度
| 锌的状态
|
A
| 0.5mol·L-1
| 20℃
| 块?状
|
B
| 0.5mol·L-1
| 20℃
| 粉末状
|
C
| 2mol·L-1
| 35℃
| 块?状
|
D
| 2mol·L-1
| 35℃
| 粉末状
参考答案:A
本题解析:影响化学反应速率的因素有:浓度,反应物的浓度越高反应速率越快;温度,温度越高反应速率越快;压强,有气体反应的增大压强反应速率加快;催化剂,使用催化剂能改变反应速率,一般为加快反应速率;反应物的接触面积越大反应速率越快。。。。所以在上述反应中产生氢气速率最快的为A;
本题难度:一般
5、选择题 升高温度能加快反应速率的主要原因是( )
A.活化分子的能量明显增加
B.降低了反应的活化能
C.增加了活化分子的百分数
D.改变了化学反应的能量变化
参考答案:升高温度,分子能量增加,增加了活化分子的百分数,增加有效碰撞
本题解析:
本题难度:一般
|