微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn(OH)2+2Fe(OH)3+4KOH 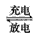 3Zn+2K2FeO4+8H2O。下列叙述不正确的是 [???? ]
3Zn+2K2FeO4+8H2O。下列叙述不正确的是 [???? ]
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3 -3e-+5OH-==FeO42- +4H2O
C.放电时负极反应为:Zn-2e-+2OH-==Zn(OH)2
D.放电时正极附近溶液的碱性增强
参考答案:A
本题解析:
本题难度:一般
2、选择题 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
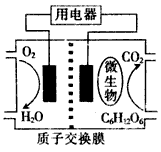 [???? ]
[???? ]
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 L
L
参考答案:B
本题解析:
本题难度:一般
3、选择题 关于铜锌原电池和电解CuCl2溶液的装置(如右图),下列说法正确的是 ??
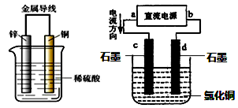
A.锌是负极,铜片上有气泡产生,电流从锌片经导线流向铜片
B.铜片质量逐渐减少,氢离子在铜片表面被还原
C.d为阳极,电极反应为:2Cl—-2e—=Cl2↑
D.电解过程中, d电极质量增加
参考答案:D
本题解析:A 错误,是电子从锌片经导线流向铜片
B 错误,铜片质量不变
C 错误,d为阴极,Cu2++2e—=Cu
D 正确,铜在d电极析出,质量增加。
本题难度:一般
4、实验题 按要求对下图中两极进行必要的连接并填空:
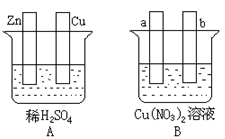
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,
则连接后的装置叫???????????????。
电极反应式:锌板:????? _______________;
铜板:????????? ___________
(2)在B图中,(a和b均为惰性电极)
使a极析出铜,请加以必要的连接后,该装置叫???????????????。
电极反应式,a极:??????????????;b极:??????? ??????。
在经过一段时间后,停止反应并搅均溶液,溶液的pH????????(升高、降低、不变),加入一定量的????? ????后,溶液能恢复至与电解前完全一致。
参考答案:联接画线略。(1)原电池,锌板:Zn-2e- =Zn2+铜板
本题解析:
联接画线:如下图。
⑴原电池,锌板:Zn-2e- =Zn2+铜板:2H2+ +2e-=H2↑(2)电解池,a极为阴极:Cu2++2e- =Cu,b极为阳极:4OH――4e-=O2↑+2H2O,电解后,生成HNO3,溶液PH降低,生成的铜和氧气,加入CuO溶液能恢复至与电解前完全一致。

本题难度:简单
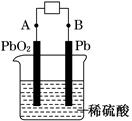
5、填空题 (14分)铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:?
Pb+PbO2+4H++2SO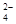
 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):?
(1) 该蓄电池放电工作时的负极材料是????????,用其电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加???????g。
充电时,上图中A极应接直流电源的??????????????(填“正极”或“负极”)。充电时A极的电极反应式是????????????????????????????;
(2) MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式 ????? 。现以铅蓄电池为电源电解,当蓄电池中有0.4mol H+被消耗时,则电路中通过的电子的物质的量为????,MnO2的理论产量为 ? g。
参考答案:(1)铅??48,?正 ??PbSO4+2H2O-2e-=
本题解析:
试题分析:(1)根据电池的总反应可知,铅蓄电池放电时的负极发生氧化反应,所以负极材料为Pb,发生的电极反应为Pb-2e-+SO42-=PbSO4,因此负极增加的质量为SO42-的质量,用该电池电解氯化钠溶液时,当阳极上收集11.2L氯气时,转移1mol电子,所以负极增加48g。充电时,A极应发生氧化反应,所以与电源正极相连,电极反应为PbSO4+2H2O-2e-= PbO2+4H++SO42-。
(2)电解酸化的MnSO4溶液,阴极发生还原反应,电极反应为2H++2e-=H2。根据铅蓄电池的
本题难度:一般