微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)水的电离平衡曲线如下图所示。
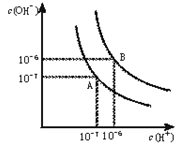
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从???????增加到????????。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为??????。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为????????????????????。
(4))25℃时,在等体积的① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是??????????
参考答案:(8分)(1)10-14? 10-12各1分
(2)2
本题解析:略
本题难度:简单
2、计算题 25°C时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH="b" 的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3??????(填“可”或“否”),其理由是???????????????????
(2)a值可否等于5??????(填“可”或“否”),其理由是???????????????????
(3)a的取值范围是???????????????????????????????????????
参考答案:(1)否,若a=3,则b=6,碱溶液显酸性,与题意不符
本题解析:考查pH的有关计算。
(1)如果a=3,则根据a=0.5b可知,b=6。由于在常温下碱溶液的pH一定是大于7的,因此假设是不能成立的。
(2)如果a=5,则根据a=0.5b可知,b=10。此时c(H+)=10—5 mol/L,c(OH-)=10—4 mol/L,
Va/Vb= c(OH-)/c(H+)>1,不合题意.因此假设是不能成立的。
(3)根据Va/Vb= c(OH-)/c(H+)可知,Va/Vb= 10(a+b-14)<1 ,故(a+b-14)<0。由于a=0.
本题难度:一般
3、选择题 在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是
A.pH=3的醋酸跟pH=11的氢氧化钠溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的HNO3跟pH=11的KOH溶液
参考答案:A
本题解析:
试题分析:醋酸是弱酸,pH=3的醋酸溶液的浓度大于0.001mol/L,所以A中醋酸过量,溶液显酸性,pH小于7;同样分析,B中氨水过量,溶液显碱性,C和D中恰好反应,溶液显中性,答案选A。
点评:对于酸和碱中和后溶液酸碱性的判断,需要特别注意的是,不能首先判断生成的盐是否水解,而应该是先判断酸碱的过量问题。只有当酸碱恰好反应时,才能考虑生成的盐是否水解。
本题难度:一般
4、选择题 下列有关水的叙述正确的是
A.水是一种非电解质
B.纯水中c(H+)随着温度的升高而降低
C.由液态水结成冰的过程是一个熵增的过程
D.25℃,pH相同的氢氧化钠溶液与醋酸钠溶液,水的电离度前者小于后者
参考答案:D
本题解析:
试题分析:A.水是一种弱电解质,不是非电解质;B.纯水温度的升高,电离程度增大,c(H+)随只增大;C.由液态水结成冰的过程混乱度减小,即是一个熵减的过程;D.NaOH在水中电离出OH-,抑制了水的电离;CH3COONa在水中,CH3COO-水解结合水电离出的H+,促进了水的电离,故2 5℃,pH相同的氢氧化钠溶液与醋酸钠溶液,水的电离度前者小于后者。
本题难度:一般
5、选择题 pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是(???)

A.X、Y两种碱的物质的量浓度一定相等
B.稀释后,X溶液碱性比Y溶液碱性强
C.若9<a<11,则X、Y都是弱碱
D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
参考答案:C
本题解析:由于稀释可以促进弱电解质的电离,所以对于pH相等的碱溶液,相对弱的碱的pH减小的幅度要小,即酸Y较弱;均稀释到1L时,Y的碱性略强。
由图知两种碱的碱性强弱Y<X,所以pH=11时的两溶液,由c(H+)=c·α公式可知,两碱的物质的量浓度一定不相等;但Y是不是强碱,也不能肯定,如果a=9,则可肯定X为强碱,否则为弱碱
D:由Y的碱性较弱,再由c(H+)=c·α可知Y的c较大,,其物质的量较大,中和时耗盐酸较多
本题难度:一般