微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向FeCl3溶液中加入ag铜粉,搅拌使之全部溶解,再向其中加入bg铁粉,充分反应后过滤得滤渣cg,若已知a>b>c,则c克滤渣和溶液中存在的阳离子分别是( )
A.Fe,Fe2+
B.Cu,Fe2+、Cu2+
C.Cu、Fe,Fe2+、Cu2+
D.Cu,Fe2+
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列各组金属最合适用氢气或CO把它们从化合物中还原出来的是(???)
A.Ca、Mg
B.Al、Fe
C.Fe、Cu
D.Hg、Ag
参考答案:C
本题解析:在金属活动顺序表中,位于氢后面的金属(如Hg、Ag等),适合用热分解法冶炼;位于氢前面的几种很活泼的金属(如K、Na、Mg、Ca、Al等)适合用电解其熔融盐或氧化物的方法来冶炼;多数金属(如Fe、Cu等)的冶炼可用热还原法。
本题难度:一般
3、选择题 下列有关含铜化合物的说法错误的是(设NA为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B.0.1mol/L的CuSO4溶液中,Cu2+的数目一定小于0.1NA
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS)
参考答案:B
本题解析:
试题分析:A、铜锈的主要成分是碱式碳酸铜,所以可用盐酸可以洗去铜表面的铜锈,A正确;B、由于不能确定硫酸铜溶液的体积,因此0.1mol/L的CuSO4溶液中,Cu2+的数目不一定小于0.1NA,B不正确;C、铁离子的氧化性强于铜离子,所以在CuCl2和FeCl3的混合溶液中加入铁粉,铁首先与铁离子发生氧化还原反应,然后再与铜离子发生置换反应。因此若有固体残留,则其中一定含有铜,C正确;D、在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明不能生成硫化亚铁。因此根据沉淀容易向更难溶的方
本题难度:一般
4、实验题 氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题:
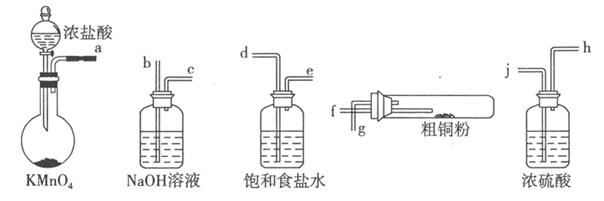
(1)按气流方向连接各仪器接口顺序是:a ????、???
????、??? ??????、????
??????、???? ?????、 ???
?????、 ??? ???????
???????
(2)写出加热时硬质试管中发生化学反应的方程式是?????????。
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是?????????????.
II.将上述实验制得的固体产物按如下流程操作,试回答下列问题:
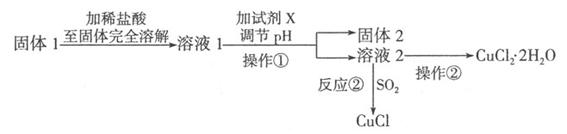
(1)检验溶液2中是否含有杂质离子的试剂是???????????;
(2)某同学用实验制得的CuCl2·2H2O晶体配制0.1 mol·L-1的CuCl2溶液,在称量出CuCl2·2H2O晶体后,溶解该晶体的具体操作为 ??????????????????
(3)溶液l可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)????
a.NaOH??? b.NH3·H2O??? C.CuO? d.CuSO4??? e.Cu2(OH)2CO3
(4)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:????????????????????????? .
参考答案:Ⅰ:(1)d e j h f g b(3分)(2)Cu+Cl
本题解析:
试题解析:(1)制得的氯气先通过饱和食盐水除去氯化氢气体,再通过浓硫酸除水,然后再通入粗铜中,最后进行尾气处理。(2)在硬质试管中铜和铁都与氯气反应;(3)根据题目信息可知,电池反应应该为铁和次氯酸钠反应,故正极为次氯酸根得电子生成氯离子。Ⅱ:(1)固体1中加入盐酸反应后溶液中含有铁离子、铜离子和亚铁离子,加入试剂目的是把亚铁离子氧化成铁离子,调节pH使铁离子水解生成沉淀而除去,故溶液2中的杂质离子为铁离子,加入KSCN溶液检验;(2)溶解氯化铜时要加入盐酸抑制铜离子的水解;(3)加入的试剂X能与
本题难度:困难
5、填空题 (1)现有浓度各为1?mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:
①充分反应后铁粉有剩余,则溶液中一定含有__________阳离子,一定没有__________阳离子。有关反应的离子方程式是___________________。
②充分反应后铁粉无剩余,有铜生成。则反应后的溶液中一定含有_________阳离子;溶液中可能含有_________阳离子,该阳离子在溶液中物质的量的可能存在范围是:??______________________。
③充分反应后,无固体沉淀物存在,反应后的溶液中一定含有____和____阳离子。
(2)现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为0.1?mol。在此溶液中加入90?mL?4?mol?/?L的NaOH溶液,使其充分反应;设Al3+的物质的量与总物质的量的比值为x。?
①根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是___________;物质的量是__________mol。
②计算沉淀中只有Fe(OH)3时的x的取值范围___________。
参考答案:(1)①Fe2+;Fe3+、Cu2+;2Fe3+ +Fe =
本题解析:
本题难度:一般