微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图是产生和收集气体的实验装置,该装置不适合于????????

A.用锌和盐酸制取H2
B.用NH4Cl和Ca(OH)2制取NH3
C.用电石和饱和食盐水制取C2H2
D.用H2O2在MnO2催化下制O2
参考答案:B
本题解析:
试题分析:用NH4Cl和Ca(OH)2制取NH3,是固体混合物的反应,需要加热,故不能使用图中装置。
本题难度:一般
2、实验题 (16分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:

请根据以上信息回答下列问题:
I.(1)写出N的化学式和B的名称:N?????、B?????。??
(2)写出反应②的化学方程式,并标出其电子转移的方向和数目:?????
(3)写出反应③的离子方程式:?????,
Ⅱ.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸?②氯化钡溶液
③氢氧化钠溶液?④碳酸钠溶液,以上试剂添加的顺序可以为?????。
A. ②③④①???????????????? B. ③④②①???????????????? C. ④③②①????????? D. ③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是?????。
A.分解反应?????????????? B.化合反应?????????????? C.置换反应??????? D.复分解反应?
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是?????。
A.从外地购买????????????????????????????????? B.在当地新建生产厂
C.从本厂生产烧碱处循环???????????????? D.从本厂生产镁 单质处循环
单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有?????性。
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适? ?????(填“甲”或“乙”),理由是?????。
?????(填“甲”或“乙”),理由是?????。
参考答案:(16分)Ⅰ. (1)HCl (1分)、石灰乳(1分)
本题解析:略
本题难度:简单
3、填空题 (10分)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
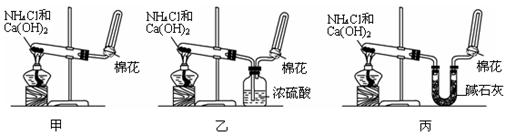
(1)三位同学制取氨气的化学方程式为:_______________________
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是_________
A、氨气难溶于水?? ??????????B、氨气极易溶于水
??????????B、氨气极易溶于水
C、氨气密度比空气大???????? D、氨气密度比空气小
E、氨气密度比水大?????????? F、氨气密度比水小
(3)三位同学用上述装置制取氨气时,其中乙同学没有收集到氨气,收集不到氨气的主要原因是____________________ (用化学方程式表示)。
(4)检验氨气是否收集满的方法是_________
A、闻到有氨气逸出
B、棉花被气体冲出
C、用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D、用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是___________(填“甲”、“乙”或“丙”)。
参考答案:(1)2NH4Cl+Ca(OH)2====CaCl2+2NH
本题解析:略
本题难度:一般
4、选择题 下列实验不能达到预期目的的是
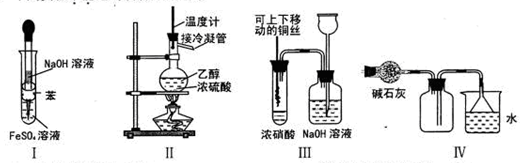
A.利用I制取Fe(OH)2
B.利用II装置制取CH2=CH2
C.利用III装置进行铜与浓硝酸反应的实验
D.利用IV装置收集NH3
参考答案:B
本题解析:
试题分析:苯不溶于水,密度比水小,则试管中溶液分层,位于上层的苯能隔绝空气,防止硫酸亚铁溶液氧化,将盛有NaOH溶液的长胶头滴管深入位于下层的硫酸亚铁溶液中,二者不仅能发生复分解反应,生成白色的氢氧化亚铁沉淀和硫酸钠溶液,而且能防止空气中的氧气将氢氧化亚铁氧化为氢氧化铁,故A项能达到实验目的;常温常压下乙醇是液体,在浓硫酸作用下,混合溶液加热到170℃时发生消去反应,生成乙烯,若混合溶液加热到140℃时发生取代反应,生成乙醚和水,因此温度计地水银球必须伸入乙醇和浓硫酸的混合液中,蒸馏时温度计水银球才能与蒸馏烧瓶支管口相平,故B项不能达到实验目的;浓硝酸与氢后金属铜接触时容易发生氧化还原反应,生成硝酸铜、二氧化氮和水,因此试管和集气瓶内出现红棕色气体,使铜丝离开液面时,反应停止,由于二氧化氮有毒,需要用NaOH溶液吸收多余的二氧化氮,二者发生氧化还原反应,生成硝酸钠、亚硝酸钠和水,空气沿长颈漏斗的长管进入集气瓶中,可以防止倒吸,故C项能达到实验目的;氨气是碱性气体,通常用碱性干燥剂除去其中混有的水分,氨气的密度比空气小,极易溶于水,因此不能排水法收集,只能用向下排空气法收集,图中氨气短进长出能干走集气瓶内的空气,多余氨气用水吸收时需要防止倒吸,倒扣漏斗的口与水面相平,既能充分吸收氨气,又能防止倒吸,故D错误。
本题难度:一般
5、填空题 有A、B、C、D、E、F六种物质,它们之间相互转化关系如图所示(条件及部分产物未标出)。
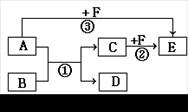
(1)若A、D为气体,都能使澄清的石灰水变浑浊;B、F做焰色反应,透过蓝色钴玻璃观察为紫色, B、C为正盐,F的溶液为紫红色。则C和F在酸性溶液中发生反应②的离子方程式为??????????????。??????????????
(2)若1 mol A分子中含有3 mol极性共价键, B、C、F都是短周期元素组成的非金属单质;常温下,只有D为固体,其它为气体。则反应③的化学方程式为????????????????????????????????????。?
某同学设计了如图所示装置(夹持仪器省略)进行上述(2)中物质B的化学性质探究。
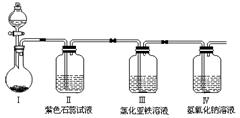
①你认为此装置设计是否合理?若不合理如何改进:???????????????????????。(若合理此问不答)
②Ⅱ中产生的现象是?????????????????????????????????????????????????????????????????。
③反应几分钟后,检验Ⅲ中可能含有的金属阳离子的实验操作是????????????????????????????。
④通过以上探究,气体B的主要化学性质是?????????????????????????????????????????????。
参考答案:(12分)(1)5SO32-+2MnO4-+6H+=2Mn2
本题解析:
试题分析:(1)若A、D为气体,都能使澄清的石灰水变浑浊,这说明二者是CO2和SO2;B、F做焰色反应,透过蓝色钴玻璃观察为紫色,说明含有钾元素。 F的溶液为紫红色,这说明F是高锰酸钾。由于F能和A反应,说明A是具有还原性的,所以A是SO2,D是CO2。B、C为正盐,所以B是碳酸钾,C是亚硫酸钾。则C和F在酸性溶液中发生反应②的离子方程式为5SO32-+2MnO4-+6H+=2Mn2++5SO42-+3H2O。
(2)若1 mol A分子中含有3 mol极性共价键,因此A是氨气。B、C、F都是短周期元素组成的非金属单质;常温下,只有D为固体,其它为气体,这说明B应该是氯气,C是氮气,D是氯化铵,F是氧气,E是NO,则反应③的化学方程式为4NH3+5O2 4NO + 6 H2O。
4NO + 6 H2O。
①由于在制备氯气时,浓盐酸具有挥发性,所以生成的氯气中含有氯化氢,或干扰后续的实验,因此是不合理,应在Ⅰ、Ⅱ之间加上除去HCl的装置,可以用饱和的食盐水除去氯化氢。
②氯气溶于水生成盐酸和次氯酸,具有酸性和强氧化性,所以Ⅱ中产生的现象是石蕊溶液先变红后褪色。
③氯气具有强氧化性,能把氯化亚铁氧化生成氯化铁,所以反应几分钟后,检验Ⅲ中可能含有的金属阳离子的实验操作是取溶液少许分别加入两支试管中,向其中一只滴加硫氰化钾溶液,若溶液变红,则含有Fe3+;向另一只试管中滴加铁氰化钾溶液,若产生蓝色沉淀,则含有Fe2+。
④根据以上分析可知,氯气的主要性质是强氧化性,能与水、与碱反应,水溶液具有酸性和氧化(漂白)性。
点评:该题是中等难度的试题,试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和发散思维能力,也有助于培养学生规范、严谨的实验设计能力。该题的难点是框图题的判断,需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般