微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同温度、相同物质的量浓度的下列各组溶液,按pH值依次减小的顺序排列的是(???? )
A.CH3COONa、Na2CO3、NaHSO4、NaCl
B.HCl、CH3COOH、NH4Cl、NaHCO3
C.NaOH、Ba(OH)2、H2SO4、HCl
D.NH4Cl、CH3COOH、NaHSO4、H2SO4
参考答案:D
本题解析:碳酸的酸性弱于醋酸的,所以碳酸钠的碱性大于醋酸钠的,A不正确。B是依次增大的。氢氧化钡是二元强碱的,蓝色是二元强酸,C不正确,所以正确的答案是D。
本题难度:简单
2、填空题 现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加?????(填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答:?????????????????????????????????????。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是?????????。
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)="0.1" mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比=???????。
参考答案:(1)CO32- + H2O 本题解析:
本题解析:
试题分析:(1) 纯碱碳酸钠是强碱弱酸盐。在溶液中存在的水解平衡主要是CO32- + H2O HCO3- + OH-,还有HCO3- + H2O
HCO3- + OH-,还有HCO3- + H2O 本题难度:一般
本题难度:一般
3、选择题 下列热化学方程式书写正确的是(△H的绝对值均正确)(?????)
?
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)==SO2(g);△H=-296.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (7分) DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
(1) 用_________________(填仪器名称)量取10. 00mL的食用白醋,在烧杯中用水稀释后转移到100mL________(填仪器名称)中定容,然后将稀释后的溶液倒人试剂瓶中。
(2)量取20. 00 mL的上述溶液倒入烧杯中,连接好DIS 系统(如上图),向烧杯中滴加浓度为0.1000mol·L -1的氨水,计算机屏幕上显示出溶液导电能力随
氨水体积变化的曲线(见图)。
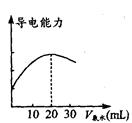
①用滴定管盛氨水前,滴定管要用__________润洗2~3遍
②氨水与醋酸反应的离子方程式是___________________。
③食用白醋中醋酸的物质的量浓度是__________________。
参考答案:(7分)
 本题解析:略
本题解析:略
本题难度:一般
5、选择题 下列符号代表的微粒不影响水的电离平衡的是
A.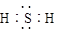
B.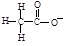
C.X3+:1s22s22p6
D.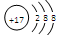
参考答案:D
本题解析:H2O H++OH-,受温度、H+、OH-、盐的弱离子的影响;H2S为酸抑制水的电离、CH3COO-、Al3+为弱离子促进水的电离;Cl—不影响水的电离平衡;
H++OH-,受温度、H+、OH-、盐的弱离子的影响;H2S为酸抑制水的电离、CH3COO-、Al3+为弱离子促进水的电离;Cl—不影响水的电离平衡;
本题难度:一般