微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):
①_____,②_____。从能量转换的角度看,过程Ⅱ应是____能转化为_____能。
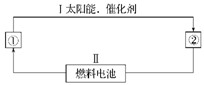
(2)图中的燃料电池也可以用A和氧气为原料。已知A分子是由碳和氢两元素的原子构成,并且8.00 g A中含有3.01×1023个分子。实验测得在298 K时,1 mol该气体完全燃烧生成液态水和二氧化碳,放出890 kJ的热量。
①写出该气体的化学式:______。
②写出1 mol该气体燃烧时的热化学反应方程式:_____________。
③已知1 mol液态的水变成气态水时需要吸收44 kJ的热量,则1 mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为________kJ。
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极反应为______________。
参考答案:(12分)
(1)①H2O? ②H2和O2 ??化学?
本题解析:(1)水在太阳能作用下分解为氢气和氧气,而氢气和氧气通过发生原电池反应产生电能,同时生成水。
(2)①由题意很容易可知A的式量为16,属于烃,也只能为甲烷;
②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
③H2O(l)= H2O(g)?ΔH=+44 kJ/mol,将③+2×②,可得:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ/mol
④氧气得电子
本题难度:一般
2、填空题 (7分)某同学用0.1082mol/L 的NaOH溶液滴定未知浓度的盐酸,以下是实验数据记录表。
实验序号
| 待测盐酸溶液的体积mL
| 滴定管读数
| 消耗标准NaOH溶液的体积mL
|
初读数
| 末读数
|
1
| 20.00
| 0.00
| 19.90
| 19.90
|
2
| 20.00
| 0.05
| ?
| ?
请根据右图(滴定管的局部)读出第2次实验的末读数,
填充上表中的两个空格。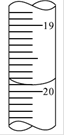
参考答案:19.90;19.85
本题解析:略
本题难度:一般
3、实验题 (14分).酸碱中和滴定是中学化学常见实验。
Ⅰ右图表示50mL酸式滴定管中液面的位置,如果 液面处的读数是a,则滴定管中剩余液体的体积是______mL 液面处的读数是a,则滴定管中剩余液体的体积是______mL
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ 某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用 各待盛溶液润洗。 各待盛溶液润洗。
D.将物质的量浓度为1.50mol·L-1标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
滴定序号
| 待测稀硫酸的体积(mL)
| 所消耗NaOH标准溶液液的体积(mL)
| V1
| V2
|  ① ①
| 20.00
| 0.50
| 22.60
| ②
| 20.00
| 6.00
| 27.90
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
参考答案: 本题解析:略 本题解析:略
本题难度:一般
4、选择题 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是?
A.△H1>△H2>△H3
B.△H1<△H2<△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3
参考答案:B
本题解析:中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。由于浓硫酸溶于水会放出大量的热,而醋酸是弱电解质,存在电离平衡,电离是吸热的,但由于放热越多,△H越小,所以选项B正确,答案选B。
本题难度:一般
5、选择题 25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是
A.1×10-7mol·L-1
B.1×10-12mol·L-1
C.1×10-2mol·L-1
D.1×10-14mol·L-1
参考答案:B
本题解析:略
本题难度:简单
|
|